Анотація
Зберігання біофармацевтичних препаратів у ліофілізованому стані створює нові виклики для первинного пакувального матеріалу.Через зростання попиту та недоліки стандартних флаконів зі скла типу I, такими як крихкість, упродовж останніх років ринок запропонував нові типи флаконів для спеціальних застосувань парентеральних лікарських препаратів. Механічні навантаження, що виникають через зміни розмірів під час ліофілізації та відтавання, можуть змінювати властивості матеріалу, а отже, впливати на взаємодію з лікарським препаратом, що зберігається у флаконі, або на його загальну герметичність. Тому в цьому дослідженні було вивчено придатність різних флаконів з урахуванням механічного навантаження, що виникає під час підготовки та зберігання ліофілізованих лікарських препаратів. Визначено можливі способи руйнування для флаконів кожного типу. Досліджено взаємодію між поверхнею флакона та лікарським засобом, враховуючи гідрофобність поверхні, її вільну енергію, шорсткість, а також мікроскопічні зміни, проаналізовані за допомогою конфокальної лазерної сканувальної мікроскопії. Відмінності у гідрофобності, шорсткості та вільній енергії поверхні міжфлаконами різних типів не впливали на їхню продуктивність упродовж циклів ліофілізації-відтавання. Аналіз вмісту флаконів на наявність частинок, що могли походити з флакона, за допомогою методу світлової та електронної сканувальної мікроскопії в поєднанні з енергодисперсійною рентгенівською спектроскопією показав рідкісні випадки наявності частинок у флаконах зі скляним покриттям. За умов екстремального навантаження, включаючи тест на падіння у ліофілізованому стані, у полімерних флаконах із покриттям також було виявлено невелику кількість частинок. Не відзначено жодних проблем щодо функціональності флаконів під час тестування герметичності їхнього закриття, хоча проникність кисню була трохи вищою у непокритих і особливо у покритих полімерних флаконах. Загалом результати свідчать, що флакони декількох типів придатні для зберігання лікарських засобів у ліофілізованому стані, а їхній вибір має ґрунтуватися на характеристиках препарату та інших вимогах, що висуваються до продукту.
Вступ
Збільшення кількості нових біофармацевтичних молекул і скорочення термінів їхнього розроблення, зокрема щодо ліпідних наночастинок, аденоасоційованих вірусів та вірусних препаратів, спричиняє підвищений попит на лікарські засоби, що потребують зберігання у ліофілізованому стані. Деякі препарати, зокрема вакцини або онколітичні віруси, навіть потребують наднизьких температур для зберігання — нижче –60 °C (Rieser et al., 2022; Pan et al., 2023). Зберігання у замороженому стані також є ефективним рішенням для ранньої стадії розроблення біофармацевтичних препаратів, оскільки знижена рухливість молекул за низьких температур особливо уповільнює кінетику хімічної деградації (Singh &Nema, 2010).
Система закупорювання флакона (CCS) призначена для дотримання таких параметрів, як якість, ефективність та стерильність лікарського засобу протягом усього терміну його зберігання (Sacha et al., 2010; Degrazio, 2017; Schaut et al., 2017). Однак первинній упаковці часто приділяють увагу лише у разі виникнення проблеми (Sacha et al., 2010). Наприклад, адсорбція білків на поверхню флакона з подальшою десорбцією білкових частинок може значно впливати на якість та безпеку лікарського засобу (Rosenberg, 2006; Couston et al., 2012; DeCou etal., 2020). Характеристики поверхні, структура білка та склад препарату мають вирішальне значення у цьому процесі (Rechendorff et al., 2006; Xu& Siedlecki, 2007; Mathes, 2010; Varmette et al., 2010; Couston et al.,2012). Для парентеральних препаратів найпоширенішими є скляні флакони типу I з боросилікатного скла завдяки їхній хімічній інертності, прозорості та герметичності (Schaut & Weeks, 2017; Wang et al.,2018). Проте зберігання біофармацевтичних препаратів у ліофілізованому стані відбувається з певними труднощами. Ліофілізація здатна негативно впливати на якість лікарського засобу, оскільки білки можуть зазнавати деградації під час як ліофілізації, так і відтавання. Основними проблемами є холодова денатурація, деградація на межі вода/лід, зміни в мікрооточенні через концентрування замороженої фази та утворення незворотних білкових агрегатів (Privalov, 1990;Bhatnagar et al., 2007; Singh & Nema, 2010; Arsiccio & Pisano, 2020). Крім того, негативний вплив на препарат можуть справляти первинні пакувальні матеріали, наприклад втрата герметичності закупорювання (CCI) (Nieto et al., 2016; Nieto et al., 2018) або розбиття флакона, що призводить до втрати стерильності самого препарату (Zhou et al., 2012; Srinivasan et al., 2019).
Через високий попит та з огляду на певні недоліки скляних флаконів на ринок вийшли альтернативні рішення. Наприклад, флакони з хімічно зміцненого скла (Corning Valor®,2022), а також полімерні флакони, що мають покращену стійкість до розбиття та ширший діапазон pH (Sacha et al., 2010; DeCou et al., 2020). Однак полімерні флакони мають і певні недоліки, такі як проникність для кисню та інших малих молекул (Hu et al., 2006). Тому були розроблені спеціальні покриття та багатошарові системи для їхнього усунення (Weikart et al., 2017; Hasegawa, 2022).
Флакони різних типів можуть по-різному реагувати на механічні напруження, що виникають під час ліофілізації та відтавання. Важливими характеристиками первинної упаковки є фізико-хімічні властивості її поверхні, такі як шорсткість, гідрофобність і вільна енергія, що впливають на взаємодію між лікарським засобом і поверхнею флакона (Absolom et al., 1987; Rechendorff et al., 2006; Xu andSiedlecki, 2007; Mathes, 2010). Крім того, ці властивості впливають на адгезію ліофілізованої формули до поверхні флакона (Meuleret al., 2010; Zou et al., 2011; Wu etal., 2020), що може впливати на механічні сили, які виникають у процесі ліофілізації та відтавання.
Сила адгезії льоду, основного компонента водного розчину лікарського засобу, значною мірою залежить від гідрофобності поверхні, проте лише за умови, що шорсткість поверхні перебуває в схожому діапазоні (Zou et al., 2011). Різниця у термічному стисненні між формулою та флаконом також спричиняє зсувні напруження на межі контакту між флаконом і препаратом (Makkonen, 2012; Rutt et al., 2019). Важливо враховувати, що заморожений лікарський препарат може зазнавати численних температурних коливань під час наповнення, маркування, транспортування, доставлення та використання. Повторні цикли розширення та стиснення препарату й матеріалу флакона можуть потенційно призвести до змін у властивостях поверхні флакона. Хоча це може впливати на властивості препарату, досі не було проведено жодного масштабного дослідження з цієї теми.
Щоб підтримати вибір первинної упаковки, яка зберігає якість заморожених лікарських засобів, флакони з боросилікатного скла типу I, що є стандартом для парентеральних препаратів, порівнювали з альтернативними варіантами, включаючи алюмосилікатні, покриті, багатошарові та полімерні флакони. Досліджували як початковий, ненавантажений стан флаконів, так і стан післямеханічного навантаження через цикли ліофілізації та відтавання при заповненні буферним розчином (V2мл). Вимірювали шорсткість поверхні флакона, кута змочування та вільної енергії поверхні як у ненавантаженому стані, так і після десяти циклів ліофілізації та відтавання за температури між 20 і –70 °C. Крім того, вміст флакона аналізували щодо утворення частинок, які виникають із матеріалу упаковки. Потім досліджували вплив ліофілізації та відтаванняна функціональність покриттів і шарів флаконів щодо герметичності упаковки та проникності, оскільки термічне розширення та стиснення шарів, скла й полімерів відрізняються. Безпосередній вплив на білки не був метою цього дослідження, оскільки основну увагу було зосереджено на вивченні впливу первинної упаковки. Отримані результати можуть бути використані для вибору оптимальної первинної упаковки для біологічних лікарських засобів.
Матеріали та методи
2.1. Матеріали
Досліджували різні флакони об’ємом 2 мл, включаючи скляні та полімерні. Скляні флакони, а саме: (a) FIOLAX ® (Fiolax), (b) Type I plus® (T1P) та (c) Top Lyo® (TL) (Schott AG, Мюльгайм, Німеччина), а також (d) Valor®(Valor; CORNING, Inc., Биг-Флетс, США), проходили обробку на стерильній виробничій лінії за допомогою тунелю сухого нагрівання (≥250 °C;≥3 хв) для депірогенізації. (e) Флакони з нанесеним випалюванням силіконовим покриттям (SO; Adelphi Healthcare Packaging, Гейвордс-Гіт, Велика Британія) промивали вручну.
Полімерні флакони, включаючи (f) Daikyo Crystal Zenith® (CZ; WestPharmaceutical Services, Ешвайлер,Німеччина), (g) OXYCAPT™ (Oxy; Mitsubishi Gas Chemical, Токіо, Япо-нія) і (h) SiO2Plas™ (SiO2Plas; SiO2Materials Science, Оберн, Алабама,США), постачали готовими до використання (RTU).
За спеціальним запитом додатково були доставлені флакони SiO2Plas без внутрішнього покриття (SiO2Plas u). Склад і спеціальні характеристики типів флаконів наведено в таблиці.
Сироваткові пробки діаметром 13 мм і алюмінієві кримп-кришки отримані від компанії WestPharmaceutical Services (Ешвайлер, Німеччина).
Буферний розчин складався з9,3% (в/в) трегалози (Pfanstiehl, Во-кіган, США) та 0,02% (в/в) полісорбату 80 (Croda GmbH, Неттетін, Німеччина) в 10 мМ гістидину (L-гістидин і L-гістидину гідрохлорид моногідрат; S.A. Ajinomoto Omnichem N.V., Мон-Сен-Гюберт, Бельгія) за pH 6,0. Буферний розчин і воду для аналітичних цілей фільтрували перед використанням через фільтр із поліфториденілувілену (PVDF) Rotilabo 0,22 мкм (Carl Roth GmbH, Карлсруе, Німеччина). Діодометанта етиленгліколь для вимірювання кута контакту були придбані у компанії VWR International GmbH (Дармштадт, Німеччина).
Таблиця 1. Склад і спеціальні характеристики типів флаконів за посиланням на стор. 21 https://content.yudu.com/web/44k6f/0A44k6g/PIRApr25/index.html
2.2. Методи
2.2.1. Застосування механічного навантаження на флакони
Механічне навантаження ліофілізацією та розморожуванням здійснювали в динамічній кліматичній каме-і MKT240 (BINDER GmbH, Тутлінген, Німеччина). Флакони заповнювали 2 мл буферного розчину, закупорювали пробками, кріпили обтискними ковпачками та розміщували у кріобоксі у шаховому порядку. Кожен кріобокс, що вміщує максимум 49 флаконів об’ємом 2 мл, заповнювали 25 флаконами. Швидкість охолодження та нагрівання морозильної камери встановлювали на 1 К·хв–1, а температуру відстежували відносно центрального флакона у кріобоксі. Зразки піддавали до 10 циклам зміни температури між 20 і –70 °C.
Для тесту на падіння у замороженому стані флакони виймали з морозильної камери за температури –70 °C після дев’ятого циклу ліофілізації, переносили на сухий лід у спеціальну випробувальну башту для вільного падіння та кидали з висоти 1 м на сталеву пластину товщиною 3 мм у вертикальному положенні.
2.2.2. Аналіз частинок за допомогою світлової та сканувальної електронної мікроскопії з енергетично-дисперсійною рентгенівською спектроскопією
Вміст десяти флаконів (n = 10) кожного типу досліджуваної системи флакон-закупорка (CCS) переносили на полікарбонатний фільтр, покритий золотом (Unchained Labs, Плезантон, США; розмір пор — 3мкм) і фільтрували під вакуумом у ламінарному потоці повітря. Кожен флакон промивали приблизно 1 мл води, а фільтр — приблизно 5 мл води. Зображення всіх частинок на фільтрі отримували за допомогою мікроскопа Axio Imager. M2m (Zeiss, Оберкохен, Німеччина) з20-кратним об’єктивом у світлому та темному полі. Частинки ≥25мкм, які, можливо, походили від флакона, відбирали на основі морфологічних характеристик, таких як форма, прозорість і блиск (Li et al.,2014), і додатково аналізували за допомогою сканувального електронного мікроскопа Supra™ 55VP (SEM; Zeiss, Оберкохен, Німеччина) за 1 кВ. Елементний склад відібраних частинок визначали за допомогою детектора X-Max 80N і програмного забезпечення AZtecAdvanced (Oxford Instruments, Хай-Вікомб, Великобританія) за 10кВ. Для узагальнення кількості виявлених частинок результати конвертували у кількість частинок на один флакон.
2.2.3. Аналіз поверхні флаконів за допомогою конфокальної лазерної сканувальної мікроскопії
Перед аналізом флакони розрізали вздовж вертикальної осі, промивали водою для видалення залишків буфера та залишків від розрізання, а потім висушували на повітрі. Було досліджено чотири точки вимірювання (MP) вздовж вертикальної осі флакона за допомогою конфокального лазерного сканувального мікроскопа VK-X1000 (CLSM; Keyence GmbH, Ной-Ізенбург, Німеччина). MP1 розташована у зоні біля дна, котра, як повідомлялося, більш схильна до змін поверхні у флаконах зі склатипу I через процес формування флакона (Rupertus et al., 2014); MP2 та MP3 є референтними ділянками з (MP2) та без (MP3) контакту скла з препаратом; MP4 розташована в зоні контакту флакона з пробкою. Мікроскопічні зображення отримували з 20-кратним об’єктивом. Шорсткість поверхні визначали за допомогою 100-кратного об’єктива (роздільна здатність: 1024×786 пікселів) для аналізу площі 100×100 мкм у центрі зображень за допомогою програмного забезпечення Keyence Multi File Analyzer 2.2.0.93. Вплив кривизни флакона компенсували за допомогою інструмента Seccurved surf. (auto). Досліджували три флакони (n = 3).
2.2.4. Фізико-хімічна характеристика поверхні флаконів за допомогою вимірювання контактного кута
Кут змочування на стінках флаконів визначали за допомогою аналізатора крапельної форми DSA25 (Kruess GmbH, Гамбург, Німеччина) та програмного забезпечення Kruess ADVANCE 1.1.02. Верхню та нижню частини флаконів видаляли за допомогою алмазної пилки (скляні флакони) або швидкісної сталевої пилки (полімерні флакони), промивали водою та висушували на повітрі. На поверхню стінки флакона в точці MP2 наносили краплі об’ємом 5 мкл (вода, дийодометан та етиленгліколь), а контактні кути визначали в режимі еліпса (tangent-1). Методом Owens-Wendt-Rabel-Kaelble (OWRK) послуговувалися для отримання додаткової інформації про вільну енергію поверхні та внесок полярної й дисперсної енергії. Аналізували три флакони (n = 3).
2.2.5. Перевірка герметичності флакона та проникності за допомогою тесту на витік гелію
Герметичність флакона (CCI) тестували за допомогою приладу ASM340 W для тестування витоку гелію (Pfeiffer Vacuum, Аслар, Німеччина). Перед вимірюванням дно флаконів видаляли, флакони промивали та сушили за температури 40 °C. Далі їх закупорювали 13-міліметровими сироватковими пробками та закривали алюмінієвими обтискними ковпачками із залишковою силою ущільнення близько 50 Н. Флакони розміщували догори дном у спеціальному тримачі, після чого створювали вакуум. Витоки у зоні контакту пробки з флаконом спричиняли потік гелію до детектора мас-спектрометрії. Значення гелію оцінювали через 1 хв із мінімальною межею виявлення витоку 5.0·E-12 мбар·L·s–1. Аналізували дванадцять флаконів на кожну CCS та умову (без навантаження/із навантаженням) (n = 12).
2.2.6. Перевірка проникності навантажених флаконів методом аналізу газового простору
Для підготовки зразків усі порожні флакони (без навантаження та після навантаження) поміщали в герметичну камеру зі 100% азотом на 4 год. Потім їх закупорювали, а залишковий парціальний тиск кисню у флаконах вимірювали сенсором microx-4-trace.
2.2.7. Статистична оцінка
Аналіз розподілу даних проводили за допомогою Q-Q графіків і гістограм. Для логнормально розподілених даних застосовували логарифмічне перетворення перед подальшими тестами.
Результати та обговорення
Скляні та полімерні флакони різних типів як із покриттям, так і без нього тестували на їхню придатність та обмеження для зберігання заморожених лікарських препаратів. Для характеристики якості та функціональності флаконів у незміненому стані, а також після стресового впливу циклів ліофілізації та розморожування використовували різні аналітичні методи, зокрема конфокальну лазерну сканувальну мікроскопію (CLSM), вимірювання контактного кута, світлову та електронну сканувальну мікроскопію, гелієвий тест на герметичність та визначення вмісту кисню.

Рис. 1. A. Визначення точок вимірювання (MP) 1–4 уздовж вертикальної осі флакона. B. Представницькі зображення конфокальної лазерної сканувальної мікроскопії (CLSM) для точки MP4 флаконів Fiolax® (Fiolax), Type 1 Plus®(T1P), SiO2 Plas™ (SiO2Plas) і TopLyo®(TL). C.Зображення CLSM для демонстрації варіабельності поверхневих структур між флаконами: порівняннясиліконізованих (SO) та SiO2Plas флаконів із флаконами Fiolax
3.1. Вплив термічного стресу на властивості поверхні флаконів
Фізико-хімічні властивості поверхні флаконів, включаючи шорсткість, вільна енергія та гідрофобність, впливають на взаємодію рідкого лікарського засобу і поверхні флакона (Absolom et al., 1987; Xu andRechendorff et al., 2006; Siedlecki, 2007; Mathes, 2010), а також на адгезію ліофілізованого препарату до внутрішньої поверхні флакона (Meuler et al., 2010; Zou et al., 2011; Wu et al., 2020). Для дослідження впливу механічного стресу, спричиненого ліофілізацією і розморожуванням, зразки порівнювали у трьох різних умовах: незміненому (початковому), після 3 (3x F/T) і після 10 (10x F/T) циклів ліофілізації та розморожування за температури від 20 до –70 °C.
3.1.1. Шорсткість та оптичний вигляд поверхні флаконів
Аналіз чотирьох точок вимірювання (MP1–MP4) вздовж вертикальної осі флаконів за допомогою CLSM показав значні морфологічні відмінності між флаконами різних типів. Зміни морфології поверхні після ліофілізації і розморожування не спостерігали для жодного з флаконів досліджених типів. Флакони Fiolax, T1P, TL, Valor, а також полімерні CZ мали дуже гладку поверхню. У флаконів SO домінували кратероподібні структури розміром від 1 до 10 мкм (рис. 1C). На поверхні флаконів SiO2 Plas спостерігали краплеподібні структури розміром переважно ≤1 мкм, але діаметром до 7 мкм. Щодо флаконів обох типів також була зафіксована варіабельність між окремими зразками незалежно від впливу циклів ліофілізації та розморожування.
Для покритих флаконів T1P іSiO2Plas зона контакту флакона з пробкою (MP4) демонструвала більш нерівномірний патерн порівняно з таким непокритих скляних та полімерних флаконів (рис. 1B). Флакони Oxy не вдалося коректно проаналізувати за цим методом, оскільки їхня тришарова структура розшарувалася та змінила свою кривизну після розрізання.
На рис. 2 представлено результати вимірювання шорсткості поверхні, виражені середньою арифметичною величиною (Sa). Стандартні боросилікатні скляні флакони (Fiolax) мали значення Sa від 0,012 до 0,014 мкм. У флаконів Valor цей показник був значно нижчим — від 0,006 до 0,008 мкм, що робить їхню поверхню найгладкішою серед усіх досліджених зразків.
Покриті флакони T1P та TL мали показники шорсткості, близькі до таких непокритих скляних флаконів Fiolax (Sa від 0,013 до 0,017 мкм). Полімерні флакони CZ мали трохи вищу шорсткість (0,016–0,018 мкм), тоді як флакони SiO2 Plas демонстрували ще більшу шорсткість (до 0,027 мкм післятрьох циклів F/T). Шорсткість флаконів SO була подібною до такої SiO2 Plas і становила 0,018–0,025 мкм.
Ці результати узгоджуються з даними попередніх досліджень, згідно з якими силіконізація значно збільшує шорсткість поверхні порівняно з такою непокритих боросилікатним склом (Moll, 2022). Крім того, для флаконів SiO2 Plas іSO виявлено значну варіабельність між зразками, що відображено у великих стандартних відхиленнях. Ймовірно, це може бути обумовлене особливостями процесу силіконізації, який характеризується значними варіаціями рівня силіконового покриття між партіями (Liu et al., 2021).
Загалом, жодних змін у шорсткості поверхні після циклів ліофілізації і розморожування не відзначено, що свідчить про те, що механічні навантаження не вплинули на структуру поверхні.
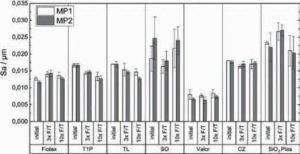
Рис. 2. Середня арифметична висота поверхні (Sa) флаконів Fiolax®(Fiolax), Type 1 Plus®(T1P), TopLyo®(TL), флаконів із силіконовим покриттям (SO), Valor®(Valor), Crystal Zenith®(CZ) і SiO2 Plas™ (SiO2 Plas) у початковому стані (initial) та після механічного навантаження під час 3 (3x F/T) і 10 (10x F/T) циклів заморожування-відтавання у точках вимірювання (MP) MP1 і MP2. Представлено середнє значення ± стандартне відхилення (n = 3)
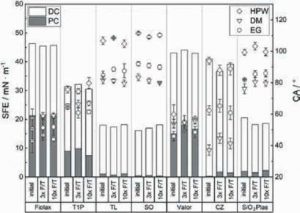
Рис. 3. Дисперсійна (DC) і полярна (PC) складові вільної енергії поверхні (SFE) флаконів Fiolax®(Fiolax), Type 1 Plus®(T1P), TopLyo®(TL), флаконів із силіконовим покриттям (SO), Valor®(Valor), Crystal Zenith®(CZ) і SiO2Plas™ (SiO2Plas). Розрахунок виконаний на основі вимірювань контактного кута змочування (CA) для високоочищеної води (HPW), дийодметану (DM) і етиленгліколю (EG). CA: Представлено середнє значення ± стандартне відхилення (n = 3)
3.1.2. Змочуваність поверхні та вільна поверхнева енергія
Результати вимірювань контактних кутів та розрахованих значень вільної поверхневої енергії представлені на рис. 3. Як і очікувалося, гідрофільні поверхні мали вищу поверхневу енергію та нижчі контактні кути для води порівняно з такими гідрофобних поверхонь.
У боросилікатних флаконах Fiolax та алюмосилікатних флаконах Valor спостерігали схожі значення загальної вільної поверхневої енергії — 45,8 ± 0,4 і 43,4 ±0,5 мН·м –1 відповідно. Покриття SiO2 у флаконах T1P призвело до зменшення полярної взаємодії, що знизило загальну поверхневу енергію до 31,3 ± 0,7 мН·м–1.
Флакони TL, SO та SiO2Plas виявилися гідрофобними, маючи контактний кут із водою ≥100° і низьку загальну поверхневу енергію (<21 мН·м–1). Непокриті полімерні флакони CZ також були гідрофобними (кут змочування водою ≈90°), але їхня загальна поверхнева енергія була трохи вищою — 38,9 ± 1,8 мН·м–1, а внесок полярної складової становив понад 95%.
Загалом, поверхневі властивості досліджуваних флаконів суттєво відрізнялися, але не змінювалися після циклів ліофілізації та розморожування.
3.2. Аналіз вмісту флаконів
Термічне стискання та розширення як формуляції, так і матеріалу флакона, а також можливе блокування замороженого розчину можуть призвести до утворення часток із внутрішньої поверхні флакона (Jiang etal., 2013). Це може бути особливо характерним для флаконів із покриттям. Частки, що походять з первинного пакувального матеріалу в парентеральних препаратах, є критичними самі по собі, а також можуть спричиняти агрегацію білків і формування часток (Rosenberg,2006; Hoehne et al., 2011; Bukofzeret al., 2015; Kopp et al., 2023). Тому попри те, що жодних фізико-хімічних або структурних змін на поверхні флаконів не виявлено, було проведено скринінг вмісту флаконів на наявність часток.

Рис. 4. Світлові мікроскопічні (LM) і сканувальні електронно-мікроскопічні (SEM) зображення частинок (P), ізольованих із вмісту флаконів. Як еталон наведено спектри енергодисперсійної рентгенівської спектроскопії (EDS) для частинок і золотих фільтрів. А. Репрезентативні скляні частинки, виявлені у флаконах TopLyo® та Type 1 Plus® після 10 циклів заморожування-відтавання. B. Репрезентативні зображення частинок, виявлених у флаконах SiO2 Plas™ після механічного навантаження та проведення тесту на падіння у замороженому стані
Вміст флаконів аналізували на початковому етапі, після 3 і 10 циклів F/T, а також по закінченні додаткового тесту на падіння у замороженому стані після 9 циклів F/T. У непокритих скляних флаконах Fiolax і Valor не було зафіксовано жодних часток, що походять із первинного пакувального матеріалу. Після 10 циклів F/T у флаконах T1P і TL було виявлено 0,4 і 0,1 частинок, схожих на скляні уламки, відповідно на контрольний зразок флакона (CCS). Після тесту на падіння у замороженому стані ідентифіковано 0,3 і 0,1 таких частинок на флакони T1P і TL відповідно. Блискучий і напівпрозорий вигляд частинок із лініями Воллнера (Sheikhet al., 2019), що зазвичай спостерігають у разі руйнування крихких матеріалів, таких як скло (Wallner, 1939), вказує на те, що частинки складаються зі скла (Li et al., 2014) (рис. 4A). Спектри енергетично дисперсійної рентгенівської спектроскопії (EDS) для представницьких часток наведено на рис. 4. Основними виявленими елементами є кремній (Si) і кисень (O2), що підтверджує ідентифікацію часток як скляних. Основний матеріал скла містить 75% SiO2 (див. таблиця).
Крім того, за морфологією ці частки чітко відрізнялися від тонких і пористих скляних пластин, що утворюються внаслідок розшарування скла (Iacocca and Allgeier, 2007; Li etal., 2014). Anger et al. (2019) описали додаткові можливі джерела утворення скляних часток, зокрема процес формування флакона та його подальшу обробку.
У непокритих полімерних флаконах жодних значущих часток у продукті не було. Формуляції, що зазнавали стресу в покритих флаконах SiO2Plas після 9 циклів F/T і подальшого тесту на падіння у замороженому стані, містили 0,3 напівпрозорих, гострокутних частинок із кремнію і кисню на флакон (рис. 4B). Висока інтенсивність золотого фільтра вказує на те, що ці частинки є дуже тонкими. Найімовірніше, вони походять з внутрішнього покриття SiO2, але відшаровуються лише після значного механічного навантаження.
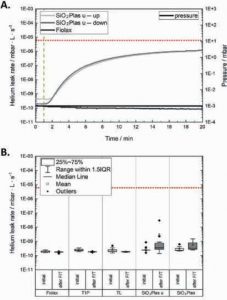
Рис. 5 А. Проникність гелію для непокритих полімерних флаконів SiO2Plas™ у вертикальному положенні (SiO2Plas u — up) та в перевернутому положенні (SiO2Plas u — down) у тримачі зразків, що описується швидкістю витоку гелію; як еталон використані скляні флакони Fiolax®(Fiolax). Зелена пунктирна лінія позначає часову точку для визначення герметичності закриття контейнера (CCI) через 1 хвилину. B. Швидкість витоку гелію для скляних флаконів із покриттям (Type 1 Plus®(T1P), TopLyo®(TL)) і полімерних флаконів із покриттям (SiO2Plas™ (SiO2Plas)) у порівнянні з флаконами без покриття зі скла (Fiolax®(Fiolax)) та полімеру (SiO2Plas u) у початковому стані (initial) і після механічного навантаження шляхом заморожування та відтавання (after F/T). Червона пунктирна лінія вказує на максимально допустиму швидкість витоку (MALL) відповідно до USP1207.1 (швидкість витоку гелію ≤6.0 E-06 мбар · L · s–1). (N = 12)
3.3. Функціональність шарів і покриттів
3.3.1. Вплив покриттів флаконів на цілісність їхнього закриття
Вплив покриттів у зоні контакту флакона та пробки на підтримання CCI до і після 10 циклів F/T досліджували методом тесту на витік гелію. Структура поверхні, візуалізована за допомогою CLSM, може впливати на CCI.
Флакони T1P і TL порівнювали зі скляними флаконами Fiolax — усі вони мали європейський відступ (EBB), а флакони SiO2Plas порівнювали з непокритими флаконами SiO2Plas (SiO2Plas u) — обидва були без відступу. Тип або відсутність відступу визначає геометрію шийки флакона, що впливає на взаємодію флакона і пробки. Таким чином, було обрано однаковий дизайн для порівняння.
Полімерні флакони мають такий недолік, як проникність для кисню та інших малих молекул, включаючи гелій (Hu et al., 2006), тому аналізували проникність непокритих флаконів SiO2Plas u для гелію. Протягом перших 2 хв тесту проникність гелію не збільшувалася (рис. 5A) незалежно від орієнтації флакона у тримачі проб. Отже, метод тестування CCI на основі швидкості витоку гелію після 1 хв є прийнятним. Флакони Fiolax не дозволяли проникнути гелію ані через ущільнення тримача проб, ані через самі флакони.
3.3.2. Результати тесту на герметичність
Результати тестування CCI представлено на рис. 5B. Швидкість витоку гелію для покритих (T1P, TL) і непокритих (Fiolax) скляних флаконів перебувала у діапазоні 1,8–2,5 E-10 мбар·L·с–1. Крім того, CCI не зазнала негативного впливу стресу внаслідок F/T.
Для полімерних флаконів — якнепокритих, так і покритих — спостерігали трохи вищі та більш варіабельні швидкості витоку гелію, що відповідало загальній проникності гелію протягом першої хвилини, а невласне CCI. Після механічного стресу швидкість витоку в полімерних флаконах дещо збільшилася. Деякі значення можуть бути визначені як аномальні за критерієм Граббса, а результати тесту Вельча засвідчили статистично значущі відмінності між початковими і F/T-навантаженими зразками, але без впливу покриття.
Проте всі рівні витоку гелію були значно нижчими за максимально допустиму межу витоку (MALL), яку визначають як максимальну швидкість витоку гелію або зазор між флаконом і пробкою, що не впливає на якість продукту (Industry Challenges and Current Technologies for Pharmaceutical Package Integrity Testing, 2021). Відповідно до USP 1207.1 максимальна початкова швидкість витоку гелію становить 6,0E–06 мбар·L·с–1(USP 2020).
Таким чином, відмінності у властивостях поверхні досліджуваних флаконів не вплинули на їхню CCI у поєднанні з вибраною пробкою. З урахуванням MALL цілісність закриття флакона не була порушена після операцій F/T.
3.3.3. Вплив ліофілізації та відтавання на проникність полімерних флаконів
Флакони з циклоолефінового полімеру (COP) проникні для кисню, що є суттєвою відмінністю від скляних флаконів. Через окислювальні шляхи деградації біологічних препаратів, зокрема білків, а також допоміжних речовин, таких як полісорбати (Torosantucci et al., 2014; Weber et al.,2023), необхідно уникати проникнення кисню. Цього можна досягти завдяки застосуванню багатошарових систем, як у випадку протестованих флаконів Oxy, наприклад через додавання шару менш проникного для кисню полімеру у внутрішню частину стінки COP (Hasegawa, 2022).
У випадку протестованих флаконів SiO2Plas флакон COP покритий з середини тришаровою системою (загальна товщина шару <500 нм), нанесеною методом хімічного осадження з парової фази, підсиленого плазмою (Weikart et al., 2017). Шар чистого SiO2, що запобігає проникненню кисню, розташований між двома силіцій-органічними шарами (SiOxCyHz): один із них слугує стійким до pH шаром контакту з продуктом, а другий — виконує функцію адгезійного підшару (Vieregg et al., 2017).
Хоча покриття було стійким до осьових стискальних навантажень (Weikart et al., 2017), можливе пошкодження через внутрішню деформацію під час F/T через понад 100-кратну різницю у коефіцієнтах термічного розширення між SiO2 (0,5·10–10К–1) і COP (70·10–10К–1) (Cyclic Olefin 2018; Li et al., 2022). Тому було проаналізовано зміну тиску кисню у верхньому просторі флаконів з одношаровою, непокритою (CZ, SiO2Plas u), покритою (SiO2Plas) та багатошаровою (Oxy) полімерною структурою після зберігання протягом 102 днів як у нестабільних умовах, так і впродовж F/T-циклів.
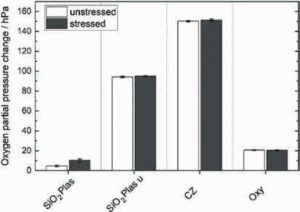
Рис. 6. Зміна парціального тиску кисню (гПа) у газовому просторі флаконів для стресованих та нестресованих SiO2Plas™ (SiO2Plas), непокритих SiO2Plas™(SiO2Plas u), Crystal Zenith®(CZ) та Oxycapt™ (Oxy) флаконів після 102 днів зберігання при 25 °C і відносної вологості 60%. Представлено середнє значення ± стандартне відхилення (n = 12)
Результати
Зміну парціального тиску кисню у верхньому просторі флаконів після зберігання представлено на рис. 6. Обидва непокриті полімерні флакони показали значне підвищення парціального тиску кисню — приблизно на 95 та 150 гПа відповідно. Відмінності між флаконами цих двох типів можна пояснити їхньою конструкцією, наприклад хімічним складом полімерної смоли та товщиною стінок флакона (Haraya and Hwang,1992; Hu et al., 2006).
Додаткові бар’єрні шари у полімерних флаконах значно зменшили проникнення кисню, знизивши тиск приблизно до 21 гПа (Oxy) і7гПа (SiO2Plas) відповідно. Незначні відмінності між нестабільними та F/T-навантаженими зразками відзначено для SiO2Plas u та CZ і Oxy.
Статистичний аналіз за допомогою тесту Велча показав, що ця різниця є значущою для SiO2Plas u таCZ, проте її практичні наслідки слід ураховувати. Найбільшу різницю виявлено у покритих SiO2Plas флаконах, ймовірно, через зміни у захисному шарі, спричинені F/T-циклами.
Ймовірним поясненням цього може бути велика різниця в коефіцієнтах термічного розширення полімерної смоли та внутрішнього покриття з кремнію діоксиду. Скорочення та розширення матеріалів під час ліофілізації та відтавання можуть потенційно призводити до мікротріщин, які не можуть бути виявлені за допомогою візуальних або мікроскопічних методів, таких як світловий або CLSM, і можуть створювати мікробіологічний ризик.
Проте покриті SiO2Plas флакони продемонстрували найвищий рівень кисневого бар’єра серед усіх досліджених полімерних флаконів, а їхні показники у нестабільному стані були найближчими до таких скляних флаконів (не зафіксовано проникнення кисню; дані не представлено). Також було повідомлено про значне зменшення швидкості проникнення кисню за низьких (≤–20°C) та ультранизьких (≤–70°C) температур зберігання (DeCou et al.,2020). Отже, проникність є основною проблемою для флаконів у неліофілізованому стані.
Висновки
Ця робота надає всебічний аналіз викликів, пов’язаних із замороженим зберіганням біофармацевтичних препаратів у флаконах як первинній упаковці.
Дослідження впливу F/T-циклів на різні типи скляних і полімерних флаконів, зокрема непокриті, покриті та багатошарові системи, показало, що фізико-хімічні властивості поверхні флаконів, включаючи змочуваність, вільна енергія та шорсткість, відрізняються між флаконами різних типів, проте не змінюються після ліофілізації та відтавання.
Крім того, не виявлено часток, що походять із флакона, у непокритих скляних і полімерних, а також у багатошарових полімерних флаконах. В окремих випадках частинки було знайдено у покритих скляних і полімерних флаконах.
Визначення CCI підтвердили, що покриття не впливає на герметичність флаконів відповідно до фармакопейних нормативів.
Вимірювання тиску кисню продемонстрували чіткі відмінності між проникністю різних полімерних флаконів, а F/T-цикли незначно збільшили проникність, особливо в полімерних флаконах із покриттям SiO2.
Отже, навіть повторне утворення льоду та відтавання, особливо на межі флакон — продукт, а також відмінності у термічній експансії, що призводять до зсувних напружень на межах, не вплинули на фізико-хімічні властивості поверхні.
Однак, оскільки ці властивості можуть суттєво впливати на механічні сили, що виникають під час ліофілізації та відтавання, їх слід оцінити в подальших дослідженнях. Це також стосується впливу різних буферних розчинів і геометрії флаконів, які можуть змінювати ступінь механічного напруження.
Загальну проникність кисню у полімерних флаконах і незначний вплив ліофілізації та відтавання напевні типи флаконів варто враховувати при плануванні досліджень, включаючи всі потенційні температурні коливання протягом життєвого циклу продукту.
Незважаючи на малу кількість частинок, через можливі побічні ефекти, такі як імуногенна реакція, слід вживати заходів, спрямованих на зниження ризику (Langille,2013; Werner, 2017).
Правильний вибір первинного пакувального матеріалу та ретельний контроль умов зберігання дозволяють зберегти якість та ефективність біофармацевтичних препаратів у замороженому стані.
Оригінальна стаття та перелік використаної літератури: