 Мария Думанчук, независимый эксперт по вопросам Track & Trace
Мария Думанчук, независимый эксперт по вопросам Track & Trace
Начало года в европейской фарминдустрии ознаменовалось запуском новой системы защиты лекарственных средств (ЛС) от фальсификации. 9 февраля вступила в действие последняя фаза Директивы 2011 / 62 / EU о фальсификации лекарственных средств (FMD) для всех членов Европейского Союза, включая такие страны, как Исландия и Лихтенштейн. Несмотря на Brexit, Великобритания, как ожидается, будет придерживаться Директивы о фальсифицированных лекарствах. Странам, в которых уже существует национальная система сериализации и / или отслеживания (например, Бельгия, Италия и Греция), будет предоставлена возможность до 2025 г. привести эту систему в соответствие с европейским подходом.
В данной статье представлен краткий обзор Европейской системы проверки лекарственных средств (EMVS), описаны механизмы взаимодействия ее участников, освещена их роль в процессе защиты от фальсификата, а также проанализированы результаты работы системы национального уровня на примере одной из европейских стран. Все аббревиатуры и сокращения приведены в оригинальном виде. Ознакомиться с ними можно в Глоссарии, приведенном в конце данной статьи.
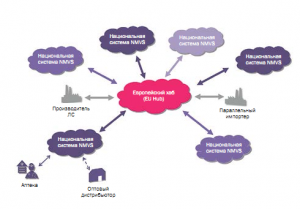
Европейская система проверки лекарственных средств (EMVS) – это новая система сквозной проверки отпускаемых по рецепту ЛС, разработанная для обеспечения безопасности пациентов путем предотвращения попадания фальсифицированных препаратов в легальную цепочку поставок. В данной системе принимают участие многие заинтересованные в
результате стороны. Она разработана, финансируется и управляется заинтересованными сторонами фармацевтического сектора.
EMVS полностью финансируют заинтересованные стороны фармацевтического сектора. ЕС и национальные правительства, а следовательно, общественность не будут делать никаких финансовых взносов.
Европейская организация проверки лекарственных средств (EMVO) представляет заинтересованные стороны, объединенные для защиты легальной цепочки поставок от фальсифицированных ЛС, членами-учредителями которой являются:
• Европейская федерация фармацевтической промышленности и ассоциаций (EFPIA)
• Лекарственные средства для Европы (Medicines for Europe) – Европейская ассоциация генериков и биосимиляров
• Фармацевтическая группа Европейского Союза (PGEU)
• Европейская ассоциация распределения медицинских услуг (GIRP)
• Европейская ассоциация еврофармацевтических компаний (EAEPC).
EMVS – это система, предусмотренная в Директиве о фальсификации лекарственных средств (Директива 2011/62/EU) (FMD) и соответствующим Уполномоченным Регламентом (EU / 2016 / 161) об элементах безопасности. Данный Регламент предусматривает две новые функции безопасности для рецептурных препаратов:
1. Уникальный идентификатор (UI) – это буквенно-цифровой код, позволяющий идентифицировать и аутентифицировать отдельные пачки. Он имеет 2D штрих-код (DataMatrix ECC200) в минимальном для печати качестве и читабельный формат. UI содержит: код продукта, серийный номер (максимум 20 символов; рандомизированный), национальный номер реимбурсации или идентификационный номер (опционально), номер серии и срок годности.
2. Контроль первого вскрытия, позволяющий защитить ЛС от несанкционированного вмешательства и гарантирующий, что упаковку невозможно физически подделать.
После нескольких лет тщательной подготовки EMVS официально вступила в операционную фазу 9 февраля 2019 г. Это означает, что все отпускаемые по рецепту ЛС, выпущенные на рынок производителем начиная с этой даты, должны соответствовать требованиям законодательства в отношении безопасности ЛС. Следует отметить, что в аптеках или больницах еще в течение 5 лет будут находиться ЛС, выпущенные до 9 февраля 2019 г.


