Проблема нітрозамінів у фармацевтичній промисловості
Оцінка вмісту нітрозамінів у лікарських засобах є серйозною проблемою для розробників. У 2018 р. Європейське агентство з лікарських засобів (EMA) повідомило про відкликання препаратів, що містять валсартан, через контамінацію нітрозамінами. Нітрозаміни є потенційними генотоксични ми агентами, і деякі з них класифікують як ймовірні або можливі канцерогени для людини. Прийнятні дози нітрозамінів деяких груп, які часто наявні в лікарських засобах, коливаються від 26,5 до 96 нг/добу (FDA США, 2021; EMA, 2022).
Домішки нітрозамінів можуть потрапляти в продукцію під час виробництва лікарської субстанції або утворюватися в процесі зберігання препаратів протягом терміну придатності. Якщо усунути домішки, що утворюються під час виробництва лікарської субстанції, цілком можливо, то щодо тих, які утворюються в готовому лікарському засобі, це виключено. Вторинні аміни можуть реагувати з нітрозуючими засобами, такими як нітрит, що призводить до утворення нітрозамінів. Отже, кількість нітритів, сукупно присутніх у лікарській формі, може впливати на рівень нітрозаміну, особливо для АФІ, схильних до розпаду.
Щоб вирішити ці проблеми, регуляторні органи тепер вимагають від власників реєстраційних посвідчень (MAH) зменшити кількість домішок нітрозаміну. Управління з контролю за харчовими продуктами та лікарськими препаратами США (FDA) і EMA рекомендують триетапну стратегію: оцінка ризику, тестування для підтвердження виявлених ризиків і звітування про зміни, внесені для запобігання та мінімізації утворення нітрозамінів (пом’якшення ризиків) (FDA США, 2021; EMA, 2022).
Під час оцінки ризиків допоміжні речовини розглядають як потенційні фактори, що спричиняють утворення нітрозамінів. Хоча ризик наявності нітрозамінів у допоміжних речовинах загалом низький, багато допоміжних речовин містять сліди нітритів, які за певних умов можуть призвести до утворення нітрозамінів. Постачальники допоміжних речовин повинні надавати відповідну інформацію, щоб допомогти власникам реєстраційних посвідчень в оцінці ризиків наявності домішок нітрозамінів у готовому лікарському засобі.
Стратегії зниження ризиків
Стратегії зниження ризиків, окреслені FDA та EMA, включають розробку рецептур і кваліфікацію постачальників з акцентом на зменшенні кількості утворених нітрозамінів.
Розробка рецептур передбачає зміну складу препарату із введенням допоміжних речовин, що мають нижчий вміст нітритів, для пригнічення утворення нітрозамінів. Як стратегії пригнічення утворення нітрозамінів пропонують також включення антиоксидантів, таких як аскорбінова кислота або альфатокоферол, та підвищення рівня pH мікросередовища.
Кваліфікація постачальників – це рекомендована стратегія, викладена в інструкціях FDA, яка може мати мінімальний вплив на реєстраційне досьє лікарського засобу. Цей підхід ґрунтується на помітних варіаціях рівнів нітратів і нітритів у різних партіях допоміжних речовин і в різних постачальників (Boetzel та співавт., 2022). Зазвичай постачальники допоміжних речовин надають інформацію про наявність нітритів виключно на основі оцінки ризиків, тоді як у деяких випадках вміст нітритів визначають за допомогою менш чутливих аналітичних методів. Внаслідок цього розрізнити таких постачальників досить складно.
Варіабельність вмісту нітритів у різних допоміжних речовинах
Розуміння варіабельності рівнів нітритів у різних допоміжних речовинах різних постачальників та у різних серіях є цінним для власників реєстраційних посвідчень, які розглядають доцільність зміни рецептур або стратегій кваліфікації постачальників. Wu та співавт. (2011) досліджували рівні нітритів і нітратів у різних допоміжних речовинах та виявили широко розповсюджені домішки, вміст яких змінювався залежно від типу допоміжної речовини та постачальника. Незначні відмінності у виробництві, такі як технологічна вода, етапи кислотного титрування та сушіння, були запропоновані як фактори, що спричиняють появу цих домішок. Згідно з інформацією, розміщеною у базі даних «Нітрити в допоміжних речовинах», що розробила компанія Lhasa Limited, як описано в статті Boetzel та співавт., було виявлено значні відмінності у рівнях нітритів між допоміжними речовинами різних постачальників.
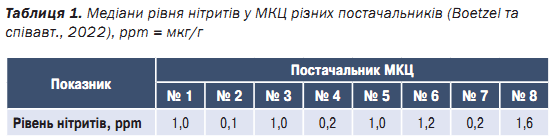
В табл. 1 наведено середні рівні нітритів у восьми постачальників мікрокристалічної целюлози (МКЦ) згідно з даними Boetzel та співавт. (2022). Важливо зазначити, що кількість проаналізованих зразків відрізнялася для кожного постачальника. Для одержання додаткової інформації читачі можуть ознайомитися з оригінальною статтею. Середні рівні нітритів можуть суттєво відрізнятися між постачальниками, з коливаннями у понад 16 разів.
Для допоміжних речовин, наявних у рецептурі в значних кількостях, таких як наповнювачі, вплив домішок є відносно високим порівняно з інгредієнтами, що вводять у низьких дозах, такими як дезінтегранти, ковзні речовини та мастила. Однак навіть для допоміжних речовин, які вводять у низьких дозах, окремі випадки можуть потребувати розгляду. Наприклад, кросповідон, супердезінтегрант, показав рівень нітритів у 9–12 разів вищий, ніж у таких наповнювачів, як МКЦ і лактоза. Отже, внесок нітритів від кросповідону все ще може бути значним, незважаючи на його нижчу концентрацію. Заміна кросповідону на натрію кроскармелозу, що має в 15 разів нижчий середній вміст нітритів, може бути оптимальним варіантом для рецептур, що містять АФІ, схильні до розпаду (Boetzel та спів авт., 2022).
Рівні нітритів у допоміжних речовинах виробництва компанії DFE Pharma
DFE Pharma як постачальник допоміжних речовин активно вирішує проблеми утворення нітрозамінів. Використовуючи досвід своєї материнської компанії Friesland Campina, яка займалася вивченням нітрозуючих засобів у харчовій промисловості, DFE Pharma розпочала підтримку власників реєстраційних посвідчень в оцінці ризиків, пов’язаних з нітрозамінами. Компанія розробила комплексну анкету, яка охоплює такі фактори ризику, як структура допоміжної речовини, процес виробництва, тип води, використання розчинника, наявність амінів і застосоване обладнання. Результати показали дуже низьку ймовірність наявності нітрозамінів та нітрозуючих засобів, що було підтверджено аналітичними даними, які демонструють, що вміст нітрозамінів, нітратів та нітритів був нижче за межу виявлення.
Спочатку використаний метод кількісного визначення не був достатньо чутливим для виявлення низьких рівнів нітритів у допоміжних речовинах. Для вирішення цієї проблеми було застосовано більш чутливий метод, а саме ISO 146732:2004 (E) «Сегментований аналіз потоку». Незважаючи на те, що цей метод був валідований для молока та молочних продуктів, а не для допоміжних речовин, він забезпечив кращу кількісну оцінку. В табл. 2 наведено дані про вміст нітритів і нітратів у допоміжних речовинах компанії DFE Pharma.
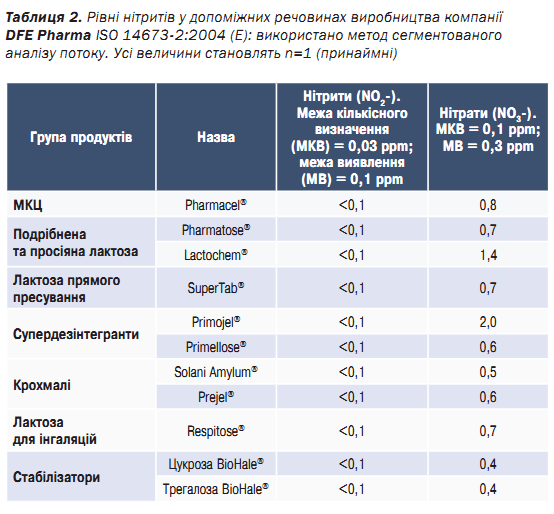
Зазвичай значення вмісту нітритів у допоміжних речовинах DFE Pharma були нижчими від межі
кількісного визначення (МКВ) 0,1 ppm. Однак основним обмеженням цього підходу було те, що більшість продуктів мали рівні нітритів нижче МКВ методу виявлення. Отже, зареєстроване значення вмісту нітритів <0,1 ppm відповідає переоціненому найгіршому сценарію, і точні значення нижче рівня МКВ залишаються невідомими. Точніші дані будуть зібрані, коли більш чутливий метод кількісної оцінки стане доступним для тестування. При порівнянні отриманих даних з висновками Boetzel та співавт. стає очевидно, що компанія DFE Pharma забезпечує низькі
рівні нітритів у МКЦ, лактозі та супердезінтегрантах.
Оберіть DFE Pharma як свого основного постачальника для зниження ризику, пов’язаного з нітрозамінами
DFE Pharma виділяється на ринку допоміжними речовинами, які мають надзвичайно низький рівень нітритів. Це досягнення відображає відданість компанії забезпеченню якості продукції протягом усього виробничого процесу. Коли справа доходить до вирішення проблеми нітрозамінів, незалежно від того, через зміну рецептури чи кваліфікації постачальника, вибір DFE Pharma забезпечує впевненість і спокій. Досвід цієї компанії у постачанні до поміжних речовин високої та стабільної якості робить її надійним вибором для потреб замовників.
Посилання:
- EMA, 2022. Запитання та відповіді для власників реєстраційних посвідчень/заявників на отримання висновку CHMP щодо статті 5 (3) Регламенту (ЄС) № 726/2004 стосовно домішок нітрозаміну в лікарських засобах для медичного застосування. EMA/409815/2020 Ред. 11.
- FDA США, 2021. Контроль домішок нітрозаміну в лікарських засобах для медичного застосування: Настанови для промисловості. Центр експертизи та досліджень лікарських засобів Сіл вер Спринг, штат Меріленд, США.
- Boetzel R., Schlingemann J., Hickert S., Korn C., Kocks G., Luck B., Blom G., Harrison M., François M., Allain L., 2022. База даних вмісту нітритів у допоміжних речовинах: Корисний інструмент для допомоги в оцінці ризику наявності N-нітрозаміну для лікарських засобів. J. Pharm. Sci.
- Wu Y., Levons J., Narang A.S., Raghavan K., Rao V.M., 2011. Реакційноздатні домішки в допоміжних речовинах: визначення профілю, ідентифікація та пом’якшення несумісності лікарських засобів і допоміжних речовин. Aaps Pharmscitech 12, 1248–1263.
Катерина Чуєнко,
менеджер відділу продажу фармацевтичної сировини
компанії IMCD Ukraine
Тел.: +38 (067) 8230210
katerina.chuienko@imcd.at
www.imcdgroup.com


