Мария Думанчук, независимый эксперт по вопросам Track & Trace
Сроки внедрения маркировки лекарственных средств (ЛС) в Российской Федерации (РФ) переносились уже несколько раз. Менялись также и группы ЛС для первоочередного внедрения. Какова ситуация с защитой ЛС от подделок в РФ сегодня?
Прежде чем изучить систему защиты ЛС, нужно выяснить, а с чем именно РФ будет бороться или что защищать?
Известно, что Европейский Союз (ЕС) начиная с 9 февраля 2019 г. защищает своих граждан от фальсифицированных ЛС [1], что описано в требованиях, предъявляемых ко всем участникам рынка, в Директиве 2011 /62 / ЕС, более известной как Falsified Medicines Directive (FMD). Система защиты ЛС от фальсификата построена таким образом, чтобы обеспечить качество препаратов для граждан ЕС по всей цепочке следования – начиная от производства активных фармацевтических ингредиентов и заканчивая аптекой.
В России с 1 июля 2020 г. маркировка станет обязательной для всех категорий ЛС (конечно, если этот срок снова не перенесут). Данные о препарате, сроке его производства и годности, а также информация о производителе будут храниться в системе «Честный ЗНАК» [2], что поможет бороться с контрабандой [3]. Целью внедрения маркировки является противодействие производству и обороту контрафактной и фальсифицированной продукции. Теперь с пониманием основной цели и предмета борьбы нам легче будет разобраться и понять систему защиты ЛС в РФ.
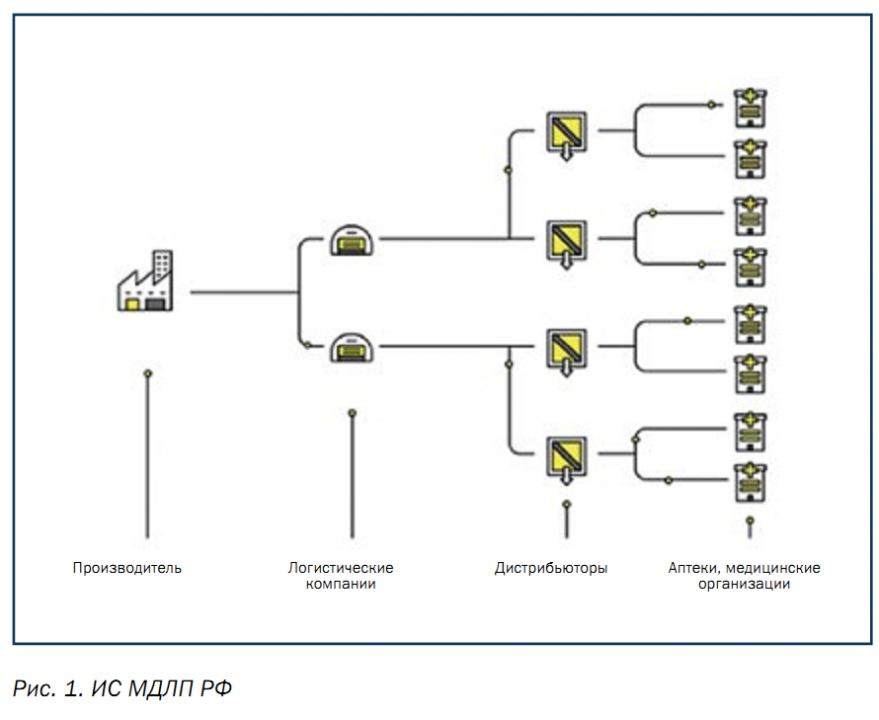
Для реализации маркировки и прослеживаемости ЛС разработана информационная система мониторинга движения лекарственных препаратов (ИС МДЛП, рис. 1) для медицинского применения, оператором которой с 1 ноября 2018 г. является Центр развития перспективных технологий (ЦРПТ). Национальная система цифровой маркировки и прослеживания товаров ЦРПТ «Честный ЗНАК» создана для сокращения нелегального оборота товаров на территории РФ и других стран ЕАЭС. Данным центром реализована система маркировки для 12 категорий товаров: шуб, табака, обуви, фотоаппаратов и ламп-вспышек, шин и покрышек, товаров легкой промышленности, духов и туалетной воды. Также на стадии эксперимента в данный момент находятся молочная продукция, кресла-коляски и велосипеды. Планируется, что система охватит все сферы промышленности к 2024 г.
В 2019 – 2020 гг. вводятся новые правила маркировки и прослеживания ЛС. Они распространяются на всех участников оборота ЛС: производителей, логистические компании, дистрибьюторов, аптеки, медицинские учереждения. Производители должны будут наносить уникальный цифровой код Data Matrix на каждую упаковку лекарств и передавать сведения о совершаемых с ними действиях в систему «Честный ЗНАК». Новшество заключается в том, что генерацию ключа и кода проверки, а также хранение криптозащищенных
кодов маркировки будет осуществлять промышленный программно-аппаратный комплекс – Регистратор эмиссии. Важно отметить, что данное устройство предоставляется фармпроизводителям за счет ЦРПТ, что в своюочередь ограничило возможности входа на рынок иностранных провайдеров решений с маркировкой и в то же время позволило государству всецело владеть информацией.
Логистические компании и дистрибьюторы должны передавать данные о полученных от поставщика и проданных кодах маркировки в систему «Честный ЗНАК». Аптеки обязаны передавать данные о полученных от поставщика кодах маркировки и о проданных упаковках через оператора фискальных данных (ОФД) с помощью онлайн-касс в систему «Честный ЗНАК». Медицинские учреждения должны отправлять данные о выбытии ЛС с помощью регистраторов выбытия (рис. 2), которые предоставляются за счет оператора системы.
Обязательность маркировки регулируется нормативными документами: ФЗ № 61 «Об обращении лекарственных средств», Постановлениями Правительства РФ: № 1556 «Положение о системе МДЛП», № 1557 «Об особенностях внедрения системы МДЛП», № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе».
Для маркировки ЛС выбран код Data Matrix. Он содержит серийный номер и глобальный идентификационный номер торговой единицы (GTIN), идентификатор ключа проверки и значение кода проверки для обеспечения криптографической защиты информации. В код также могут быть включены такие поля, как дата истечения срока годности и номер серии в установленных законодательством формах.
Состав информации определяется нормативным правовым актом правительства РФ. Код маркировки Data Matrix наносится на вторичную (потребительскую) упаковку, а если таковая не предусмотрена, то на первичную упаковку. Data Matrix делится на две части: код идентификации, определяющий позицию товара в системе и едином каталоге товаров, и код проверки или криптохвост, который генерирует оператор с помощью отечественных технологий криптографии.