Пострелиз доклада в рамках Международной онлайн-конференции «Индустрия 4.0: высококачественные АФИ, эксципиенты и разработка рецептур для фармацевтических препаратов, косметических продуктов и товаров для здоровья»
Валентин Могилюк, Valentyn.Mohylyuk@gmail.com
2 декабря 2020 г. в рамках Международной онлайн-конференции «Индустрия 4.0: высококачественные АФИ, эксципиенты и разработка рецептур для фармацевтических препаратов, косметических продуктов и товаров для здоровья» состоялась презентация [1], детали которой приведены ниже. Задачей этого доклада было всего за 20 мин постараться очертить наиболее важные тенденции в генерической фармотрасли, которые нас ждут в обозримом будущем.
Прежде всего хотелось бы напомнить об основной особенности генерической отрасли, заключающейся в том, что генерические препараты представляют собой копии оригинальных лекарственных средств, но 15 – 20 лет спустя. Порой довольно сложно «раскусить» технологию 20-летней давности. Следует помнить, что большинство оригинальных препаратов выходят из лабораторий больших фармкомпаний, которые консолидируют лучших представителей отрасли, двигающих вперед и компании, и науку. Однако на момент окончания срока патентной защиты конъюнктура научно-технической среды существенно меняется. Оборудование, как аналитическое, так и технологическое, методы анализа и регуляторные требования значительно совершенствуются. Некогда передовые идеи становятся хорошо исследованными и разработанными направлениями, поэтому открываются новые возможности, которые позволяют оптимизировать подходы к разработке, доказательству эффективности и безопасности, а также производству генериков. Это дает даже генерическим компаниям возможность создавать модифицированные генерики, которые по определенным параметрам могут превосходить своих оригинальных предшественников. Поэтому держать руку на пульсе тенденций в отрасли полезно как в краткосрочной, так и в долгосрочной перспективе, а еще лучше быть «на передовой» или непосредственно участвовать в их формировании. Поэтому давайте перейдем к обсуждению этих вопросов.
Сегодня на обсуждение тенденций в генерической фармотрасли вынесены следующие темы: повышение уровня предсказуемости результатов исследований in vitro в сравнении с таковыми in vivo; улучшение эффективности, комплаенса (приверженность пациента к лечению или удобство применения препарата) и биодоступности; непрерывное производство (continuous manufacturing); инструменты для дизайна, анализа и контроля технологических процессов – так называемый PAT (process analytical technology).
Проведение доклинических (ДИ), клинических исследований (КИ) и исследований биоэквивалентности (ИБЭ) в генерической фармацевтической отрасли сопряжено с относительно высокой долей неопределенности и большими материальными затратами, поэтому абсолютно оправданы усилия по уменьшению этой неопределенности и снижению расходов, связанных с проведением ДИ, КИ и ИБЭ. В контексте генерической фармотрасли это в первую очередь касается препаратов для перорального применения, так как поведение лекарственных форм (ЛФ) или отличие в поведении оригинальных и генерических ЛФ в желудочнокишечном тракте (ЖКТ) гораздо менее предсказуемо и подвержено влиянию множества переменных факторов. На протяжении последних десятилетий интерес к этим вопросам постоянно повышается, что подкрепляется растущим количеством публикаций и числа новообразованных/выделившихся в отдельный бизнес коммерческих организаций, специализирующихся на изучении данной проблематики.
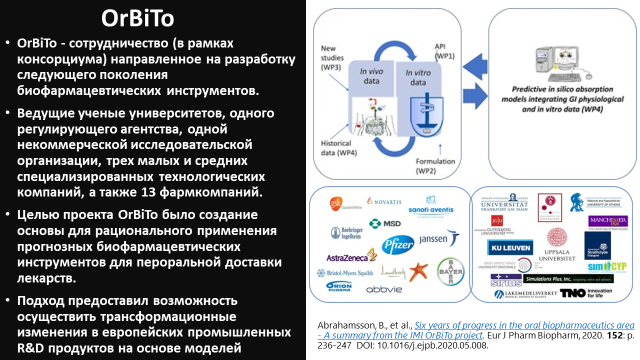
Исходя из этого, образование 5 лет назад в Европе консорциума ведущих ученых, представителей фармкомпаний и сотрудников регуляторного агентства, деятельность которого направлена на разработку следующего поколения биофармацевтических инструментов, было достаточно закономерным. Цель проекта OrBiTo (Oral Biopharmaceutics Tools) заключалась в создании основы для рационального применения
прогнозных биофармацевтических инструментов для пероральной доставки лекарств. Это дало возможность внести трансформационные изменения в европейские промышленные исследования и разработку продуктов на основе моделей [2].
Проект OrBiTo состоял из нескольких этапов, включавших: инструменты для определения физико-химических характеристик и изучения активных фармацевтических ингредиентов (АФИ); in vitro-инструменты для понимания рецептур; in vivo-инструменты для характеристики и лучшего понимания биологических систем; in silico-инструменты для интеграции данных, а также для прогнозирования in vivo-результатов. Ниже приведены ключевые слова, которые помогут в поиске научной литературы по данной теме: permeability, drug absorption, biorelevant dissolution media, physiologically-based dissolution testing, physiologically-based biopharmaceutics modelling, physiologically-based pharmacokinetic modelling/prediction, population pharmacokinetic modelling, in-vitro in-vivo correlation/evaluation (IVIVC/E).
Мы с коллегами не могли остаться в стороне от современных тенденций и презентовали несколько научных публикаций на эту тему, которые, возможно, помогут предотвратить неудачи в ваших исследованиях биоэквивалентности.
Пероральные ЛФ с отсроченным высвобождением – таблетки и пеллеты с кишечнорастворимым покрытием – являются весьма распространенными. Фармакопейные, традиционные методы контроля таких ЛФ включают имитацию рН условной желудочной и кишечной среды посредством раствора соляной кислоты с рН 1,2 и фосфатного буфера с рН 6,8. Несмотря на то что фосфатный буфер с рН 6,8 является регуляторной нормой и моделирует рН определенного отдела ЖКТ, он не моделирует состав среды in vivo, что существенно ограничивает его использование для прогнозирования высвобождения in vivo. Ранее уже были предложены подходы, которые повышали предсказуемость высвобождения in vivo и фармакокинетики опосредованных приемом кишечнорастворимых ЛФ. Эти подxоды заключались в использовании раствора бикарбоната и продувки раствора газом (СО2). Оба подхода имеют свои недостатки – нестабильность раствора и образование пузырьков воздуха на поверхности тестируемой ЛФ соответственно. Последнее существенно затрудняло и ухудшало надежность тестирования кишечнорастворимых пеллет, особенно микропеллет. Поэтому, основываясь на законе Генри, мы предложили метод тестирования, где рН раствора бикарбоната регулировался нагнетаемым под давлением СО2 или N2. Предложенный метод нивелировал недостатки предшественников (нестабильность, плохая воспроизводимость и образование пузырьков газа на поверхности ЛФ), а биорелевантная среда (моделирующая среду кишечника) позволила робастно тестировать и определять потенциальные различия in vivo поведения ЛФ [3].
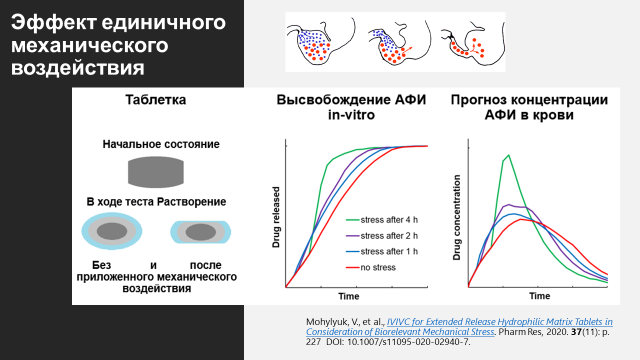
Еще одна тема, которую мы с коллегами хорошо изучили – влияние механического воздействия ЖКТ на высвобождение АФИ из гидрофильных матричных таблеток. Обычные фармакопейные тесты не позволяют оценить эффект механического воздействия со стороны ЖКТ на высвобождение из матричных таблеток. Однако существуют альтернативные методы оценки такого влияния. В нашем исследовании мы изучили несколько коммерческих продуктов в форме гидрофильных матричных таблеток (Tromphyllin® retard 300 mg – Trommsdorff GmbH & Co. KG, Glucophage® XR 500 mg – Merck Serono GmbH, Alfuzosinratiopharm® uno 10 mg – Ratiopharm GmbH, Seroquel® XR 50 mg – Astra Zeneca GmbH, а также Preductal® MR 35 mg – Les Laboratories Servier) и определили, как биорелевантное механическое воздействие влияет на высвобождение in vitro и IVIVC. В результате продукты были классифицированы на более и менее устойчивые к механическому воздействию. Для продуктов, более чувствительных к механическому воздействию, in vitro тестирование с использованием механической нагрузки способствовало повышению IVIVC [4].



