Автори: Andrejs Sitovs, Viktorija Cernisova, Valentyn Mohylyuk (Rīga Stradiņš University, Riga, Latvia)
Анотація
Оцінювання розчинення/вивільнення лікарських засобів є одним із найважливіших тестів для пероральних лікарських форм і має вирішальне значення в процесі розробки лікарських препаратів . Через зміну парадигми у фармацевтичних дослідженнях і процесах розробки, що зумовлено домінуванням погано розчинних лікарських речовин (класи II/IV за BCS), фармакопейні підходи до оцінювання розчинення, розроблені переважно для добре розчинних речовин (класи I/III за BCS), часто виявляються недостатньо універсальними та не забезпечують достовірного прогнозування абсорбції in vivo. Нові рецептури лікарських форм у поєднанні зі зростаючим значенням тестів проникності та моделюванням штучного травлення застосовують для вирішення проблем, що супроводжують розробку препаратів із погано розчинними діючими речовинами . В огляді представлено сучасний стан, а також описано розвиток підходів до систем тестування розчинення та проникності . Акцентовано на доступному обладнанні та висвітлено його роль у подоланні викликів щодо погано розчинних речовин . Крім того, з урахуванням системи класифікації розробок запропоновано відповідне випробувальне обладнання для лікарських засобів певних класів.
1. Вступ
Згідно з Біофармацевтичною класифікаційною системою (BCS) [1] та її модифікацією Системою класифікації щодо шляху розробки лікарської форми (DCS) [2] пероральні лікарські засоби поділяють на чотири класи залежно від їхньої проникності крізь мембрану травного тракту (ТТ) та мінімальної розчинності у рідинах, що імітують середовище відповідних відділів ТП (250 та 500 мл для ВCS і DCS відповідно) . Клас I характеризується високою розчинністю та проникністю, клас ІІ має низьку розчинність, але високу проникність, клас III — високу розчинність, але низьку проникність, а клас IV — як малу розчинність, так і низьку проникність . Для препаратів класу I профіль абсорбції у ТТ тісно корелює in vivo з профілем вивільнення з лікарської форми, що робить процес розробки форм негайного вивільнення більш передбачуваним. Препарати класу III позбавлені проблем із розчинністю, їхня абсорбція також може добре корелювати з профілем вивільнення in vivo . Проте проникність лікарських засобів класу III може бути зумовлена транспортними процесами та метаболізмом у мембрані . Внаслідок цього багато препаратів класу III демонструють обмежену кореляцію або відсутність in vitro – in vivo (IVIVC) між вивільненням препарату та його абсорбцією [1] . Це пояснюється тим, що проникність препаратів класу III залежить від транспорту та метаболізму в проникній мембрані ТТ. Історично більшість молекул лікарських засобів мала прийнятну водну розчинність, і проблеми з нею виникали рідко [3, 4] .
Згідно з правилом п'яти rule-of-five Крістофера Ліпінскі, введеним у середині 90-х років минулого століття, серед інших параметрів ліпофільність і молекулярна маса є важливими для розгляду сполуки-кандидата для перорального лікарського засобу [5-7] . Розрахований коефіцієнт розподілу октанол/вода (log P <5) є одним із критеріїв «подібності до лікарських засобів». Станом на сьогодні у портфелях розробок фармацевтичних препаратів більшість активних фармацевтичних інгредієнтів (АФІ) та молекул-кандидатів для перорального введення є високоліпофільними й мають відносно велику молекулярну масу, що зумовлює їхню малу водну розчинність і низьку біодоступність під час перорального застосування [8, 9] . Препарати класу ІІ та класу IV за ВСЅ характеризуються низькою розчинністю і, відповідно, низьким лікарським потенціалом молекули (drugability) .
Для вирішення проблеми розчинності застосовують спеціальні рецептури (enabling formulations) та послуговуються відповідними технологічними підходами [10, 11]. Серед найбільш перспективних способів подолання проблеми низької розчинності АФІ з міцними кристалічними гратками (з високими температурами плавлення, так звані молекули brick dust «кирпичний пил») є зменшення розміру кристалічних частинок, модифікація кристалічної форми та аморфні тверді дисперсії (ASDs). Для практично нерозчинних, надмірно гідрофобних АФІ з низькими температурами плавлення (так звані сполуки grease balls «жирові кульки») застосовують комплексоутворення та ліпідні лікарські форми [11, 12]. Основною метою формуляції є досягнення передбачуваної (бажано незалежної від прийому їжі), стабільної абсорбції та біодоступності, що дозволяє знизити фармакокінетичну варіабельність [11].
Проникність крізь мембрану ТП, яка визначає абсорбцію і впливає на біодоступність, має вирішальне значення для з'ясування властивостей лікарських субстанцій, а також скринінгу лікарських речовин та їхніх лікарських форм [13] . Використовують статичні тести проникності на ex vivo ізольованих тканинах ТП (гризунів та свиней, рідше людей; сегменти ТТ єюнум, дванадцятипала, клубова і товста кишки) та моношари клітинної культури аденокарциноми товстої кишки людини Сасо-2 [13]. У процесі розробки лікарських препаратів на етапі переходу від субстанції до готової лікарської форми тести in vitro розчинення/вивільнення використовують для прогнозування in vivo експозиції після прийому препарату . Ці тести, як фармакопейні, так і нефармакопейні, лише частково відтворюють умови ТП, проте завдяки накопиченим знанням і відносній простоті їх широко застосовують для визначення взаємозв'язку між вивільненням діючої речовини та її in vivo експозицією .
У цьому графічному огляді проілюстровано сучасний стан справ у сфері дослідження розчинення, описано наявне обладнання для оцінки проникності та рекомендовано найбільш відповідне устаткування залежно від біофармацевтичних властивостей лікарського засобу та типу рецептур.
2. Досягнення у дослідженнях розчинення
З метою оцінювання вивільнення лікарських засобів найчастіше застосовують фармакопейні пристрої для визначення розчинення USP1 (кошик) і USP2 (лопать) (рис. 1) [14] .
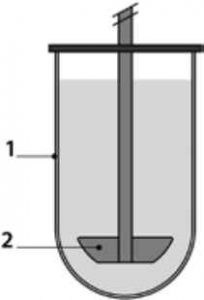
Рис. 1. Пристрій USP2: циліндрична ємність з напівсферичним дном і мішалкою: 1 - ємність; 2 - лопать.
Завдяки результатам досліджень з використанням цих рутинних фармакопейних in vitro тестів розчинення накопичено величезний обсяг даних і знань та описано кінетику вивільнення лікарських засобів у відносно простих (розведений розчин хлористоводневої кислоти, бікарбонатний, оцтовий, фосфатний чи інші буфери) або більш складних біорелевантних середовищах для розчинення (наприклад, імітовані рідини шлунка та
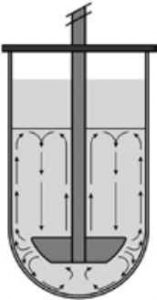
Рис. 2. Схематичне зображення гідродинаміки в пристрої USP2.
кішківника натщесерце чи після їжі) .
Процедури випробувань на розчинення є високостандартизованими з урахуванням таких параметрів, як швидкість обертання лопаті та підтримання постійної температури протягом усього тесту (зазвичай 37C) . Гідродинаміку в пристрої USP2 добре досліджено та описано (рис. 2) [15-17] .
Крім того, наразі доступна низка ємностей, які враховують обмеження фармакопейних апаратів для дослідження розчинення. Проблему утворення конуса дезінтегрованої лікарської форми на дні ємності як специфічний технічний виклик, що виникає через недоліки гідродинаміки в USP2, вирішують за допомогою ємностей Реак/Apex [18] (рис. 3).
Розчинення АФІ, схильних до фотодеградації, досліджують в ємностях із бурштинового скла. Для імітації менших фізіологічних об'ємів, наприклад під час тестування розчинення лікарських форм для дітей, застосовують малі або так звані китайські ємності (рис. 4). Одноразові ємності підходять для тестування розчинення токсичних та/або високоактивних АФІ. Для специфічних потреб існують змінні мішалки, кошики (як у пристрої USP1) та вантажі для занурення лікарських форм, також є пристосування, призначені для тестування швидкості розчинення з питомої площі поверхні (пристрій Вуда) [19].
Кількісне визначення розчиненої або вивільненої речовини здійснюють за допомогою різних систем відбору проб: у відкритому циклі (пробу періодично відбирають із ємності, де тестується вивільнення) та в замкненому циклі (після кількісного визначення зразок рідини повертають до ємності). Усі аксесуари для систем розчинення/вивільнення, вироблені різними компаніями, широко представлені на ринку [20, 21] .
Результати in vitro тестів на розчинність активно використовують для складання in vivo прогнозів (наприклад, у вигляді in
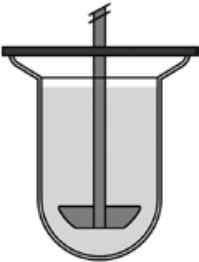
Рис. 4. «Китайська» ємність з малою лопаттю.
vitro - in vivo кореляції) переважно для препаратів класу ВСЅ I з непроблемною розчинністю [22] . Однак для препаратів класу ВCS III, IVIVC є обмеженою або відсутньою, оскільки їхня абсорбція залежить від швидкості проникності [1] . Результати розчинення in vitro також можуть бути інтегровані у симуляційні моделі (наприклад, Gastroplus™) та співвіднесені з профілями «концентрація — час» (C - t) лікарських засобів у системному кровообігу [23, 24] .
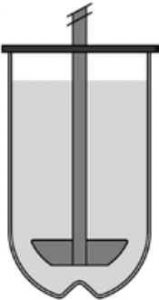
Рис. 3. Посудина Реак/Арех із мішалкою.
рН середовища для розчинення та його склад мають велике значення для іонізованих речовин і деяких допоміжних речовин (наприклад, полімерів, що розчиняються/дезінтегрують у кишківнику), оскільки вони суттєво впливають на розчинність і профілі вивільнення. З огляду на це було запропоновано склади середовищ для розчинення, ближчі до біорелевантних, а також методи стабілізації та регуляції рН [25] . Наприклад, рН бікарбонатного буфера регулювали за принципом закону Генрі, спеціально розробивши систему замкненої посудини для розчинення (рис. 5) із модифікованою герметичною кришкою з газорозподільним кільцем . Ця система дозволяла подавати гази N2 (для підвищення рН) та CO2 (для зниження рН) [26].
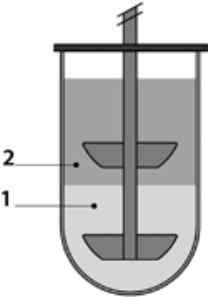
Рис. 6. Біфазна система для розчинення з лопаттю: 1 - водний шар (середовище для вивільнення); 2 - шар октанолу (середовище, що абсорбує).
З огляду на проблеми погано діючих речовин необхідні нові та більш складні підходи . Запропоновано різні нефармакопейні методи тестування розчинення, наприклад біфазні системи для розчинення [27-29] (рис. 6) . Вони дозволяють здійснювати постійне перенесення вже розчиненої речовини з водного до органічного (октанол) шару . Перенесення речовини визначається об'ємом шарів, його розчинністю в кожному середовищі, а також площею поверхні між ними . Отже, цей метод лише частково імітує in vivo абсорбцію, але його можна застосовувати для скринінгу формуляцій та їхньої оцінки.
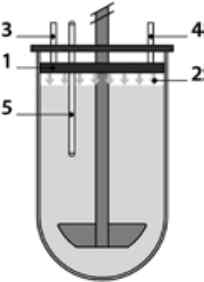
Рис. 5. Замкнений пристрій USP2 з подачею газів для регуляції рН середовища: 1 - кришка з газорозподільним кільцем; 2 - газові виходи; 3 - вхід CO2 ; 4 - вхід N2; 5 - рН-метр
Більш інноваційну in vitro систему для біфазного підходу до розчинення пероральних препаратів представлено пристроєм Bioequivalence Checker (BE Checker, рис. 7) [30] . Він складається з ємності з оригінальною геометрією та лопаттю й дозволяє корегувати рН, імітуючи перехід зі шлунка до кишківника . ВЕ Checker має водний розчин у ємності-донорі, відокремленій гідрофільною мембраною з полівініліденфториду з порами 0,22 мкм від гідрофобного октанолу від невеликої ємності-акцептора, що запобігає змішуванню двох середовищ, а також перенесенню нерозчинених частинок із водного середовища в октанол . Перемішування в камерах досягається за допомогою лопаті та магнітної мішалки відповідно . Однак геометрія ємності відрізняється від фармакопейної USP2, і наразі ВЕ Checker ще не довів сумісності ех vivo з мембранами.
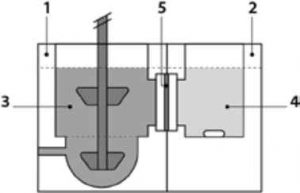
Рис. 7. Пристрій ВЕ Checker: 1 - донорна камера; 2 - акцепторна камера; 3 - водне середовище; 4 - октанол; 5 — штучна гідрофільна мембрана (фільтр).
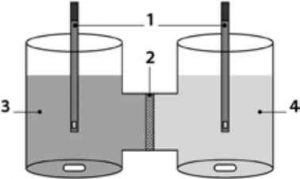
Рис. 8. Схематичне зображення MicroFLUXTM: 1 - УФ-волоконно-оптичний датчик; 2 - проникна мембрана; 3 — донорна камера із середовищем; 4 - акцепторна камера із середовищем.
3. Прогрес в оцінюванні проникності
Загалом академічна спільнота та промисловість рухаються у напрямі тестування розчинення-проникності (розчинення-абсорбції) [31] . Основні варіанти тестування проникності у лабораторних умовах без використання живих лабораторних тварин передбачають оцінювання проникності крізь штучні мембрани та крізь мембрани живих клітин . Доступні комерційні культури живих клітин, тоді як ex vivo тканини отримують від лабораторних гризунів або від свиней, забитих для харчової промисловості [32, 33] . Нещодавно було зафіксовано збільшення випадків використання ex vivo тканин людського кишківника [34, 35] .
Якщо лікарський засіб не є субстратом активного транспорту, а переважає пасивна дифузія, використання штучних бар'єрних мембран є обгрунтованим . In vitro метод РАМРА (з використанням штучної мембрани, просякнутої ліпідами) для прогнозування пасивної проникності речовин був підтверджений результатами серії експериментів і показав добру кореляцію між in vitro - ex vivo (мембрана РАМРА — висічена мембрана кишківника) та in vitro - in vivo (мембрана РAMPA – доклінічні та клінічні дослідження) [36] .
Були внесені оновлення та вдосконалення до ідеї оригінального in vitro методу РАМРА, що сприяло розробці більш складних in vitro систем оцінювання проникності, таких як аналіз проникності на основі фосфоліпідних везикул [37] та PermeaPad™ [38] . Проте базові принципи залишаються подібними. В оригінальній РАМРА штучна мембрана складається із синтетичної мембрани, імпрегнованої фосфоліпідами (наприклад, фосфатидилхолін у додекані на основі полівініліденфториду) [39] . Синтетичні мембрани, призначені для утримання фосфоліпіду, мали розмір пор від 0,1 до 3 мкм [36, 39, 40] . Використання усіх цих бар'єрних мембран має на меті імітацію проникності крізь ліпідний подвійний шар ентероцитів кишківника .
Штучні проникні мембрани успішно використовують у скринінговому обладнанні, наприклад, у MicroFLUX™ [41] (рис. 8) та MacroFLUX™ [42] (рис. 9) — системах розчинення-проникності. MicroFLUX™ за своєю конструкцією складається з камери-донора та камери-акцептора (приймальна), які розділені мембраною РАМPA, а середовища в обох камерах перемішуються за допомогою магнітних мішалок . Ця установка призначена головним чином для досліджень розчинення-проникності погано розчинних речовин (наприклад, BCS класу II) і, з урахуванням певних обмежень, її можна використовувати для тестування формуляцій . Виробник цього обладнання навіть пропонує спеціальний концентрат для додавання в середовище акцептора, щоб досягти умов, коли в цьому об'ємі такого розчину може розчинитись у декілька разів більша кількість речовини, ніж присутня у донорі станом на початок експерименту – sink-умови (pH 7.4, склад не розкрито, зазначено як Acceptor Sink Buffer - ASB) [43].
Система MicroFLUX™ дуже корисна для раннього скринінгу молекул-кандидатів та формуляцій, проте вона не відтворює компендіальні тести розчинення і не передбачає використання ex vivo мембран, що обмежує її застосування у дослідженнях речовин з активним транспортом.
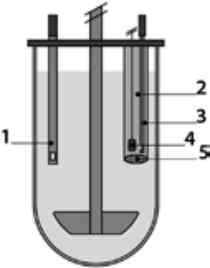
Рис. 9. Схематичне зображення MacroFLUXTM: 1 та 3 - УФ-волоконно-оптичний датчик; 2 - акцепторна камера; 4 - лопать; 5 - проникна мембрана
Переваги in situ кількісного визначення лікарського засобу в донорній камері:
-
Дозволяє отримати найбільш реалістичні відомості про концентрацію речовини в недеструктивний спосіб. Відбір проби може зменшувати кількість вивільненої речовини, тим самим штучно спотворюючи оцінку проникності .
-
Відбір проби може впливати на кількість розчиненої речовини через відсутність контролю температури (на рівні 37°C) . Оскільки речовина може бути у формі істинного розчину, міцел, у стані, де превалює полімер або діюча речовина, in situ вимірювання не порушує ці структури . У разі зміни температури їхнє співвідношення може змінюватися, а також можлива преципітація.
Переваги in situ кількісного визначення в акцепторній камері:
-
Через зазвичай невеликий об'єм акцепторної камери некоректні визначення можуть виникати за дуже низьких концентрацій речовини у відібраних зразках (наприклад, для препаратів класів BCS III та IV) .
-
Для підтримання sink-умов може виникнути необхідність заміни середовища на попередньо підігріте, що потребує додаткових маніпуляцій .
Переваги in situ кількісного визначення одночасно у донорній і акцепторній камерах:
-
Практично необмежена кількість точок відбору.
-
Не потрібні відбір і фільтрація проб, що зменшує похибки мас-балансу . Мас-баланс може спотворюватися через адсорбцію діючої речовини на мембранах фільтрів, піпетках, пробірках тощо. Концентрація речовини в зразку може змінюватися під час пробопідготовки-розведення, що може призводити до завищених результатів, оскільки розчиняються не лише молекулярно розчинені речовини, але й мікро- та нанокристали, аморфні частки, полімер-зв'язані молекули.
На жаль, УФ-квантифікація не підходить для всіх діючих речовин через особливості самих молекул або недостатню чутливість у разі низьких концентрацій . Тому й досі залишаються актуальними інші методи кількісного визначення (HPLC, UHPLC, мас-спектрометрія), що потребують відбору проб.
У дослідженнях проникності експериментально доведено важливість гідрофільного шару (імітація кишкового слизу) на поверхні ліпідної мембрани, що підтверджено IVIVC [47] . У цьому контексті нещодавно виявлений ефект дрейфу частинок [48, 49] може набувати ще більшого значення . Тому важливість стандартизованої або контрольованої гідродинаміки у донорній камері стає очевидною, і використання добре перевіреного апарата USP2 є цілком виправданим.
Існують також більш складні системи для оцінки проникності in vitro, наприклад, метод зворотного діалізу [50] чи ТТ-модель TNO [51] . Попри більшу фізіологічну схожість, їхня складність у збиранні та використанні обмежує поширення у біофармацевтичних лабораторіях.
У випадках, коли пасивна дифузія не є основним шляхом переносу, використання неспецифічних ліпідних штучних мембран стає недоцільним . Найбільш раціональними підходами є застосування моношару клітин Сасо-2 та ex vivo мембран ТП. Живі клітини є трудомісткими у використанні, оскільки потребують підтримання життєздатності за допомогою відповідного середовища . Цілісність і, відповідно, життєздатність клітинного шару має бути підтверджена за допомогою спеціального обладнання . Зазвичай вимірюють трансепітеліальний електричний опір (TEER), але також можна визначати трансепітеліальну різницю потенціалів та струм короткого замикання [35].
TEER-значення вираховують на підставі напругово-струмових характеристик. У відкритому режимі мембрана не підключена до джерела струму, але через певні часові інтервали подаються імпульси . Альтернативно можна застосовувати низьку напругу (в мВ) і розраховувати TEER за законом Ома після проходження струму . Обладнання для вимірювання TEER [52] є доступним на ринку або ж його виробляють під замовлення.
Проста система для дифузії з клітинами Сасо-2 (рис. 10) складається з багатолункових планшетів, розділених на донорні та акцепторні камери моношаром клітин Саco-2, розміщених на проникній нейлоновій мембрані з порами близько 0,4-5 мкм [52]. Акцепторні камери мають дуже малий об'єм (часто не досягають sink-умов) і працюють у статичних умовах (іноді використовують орбітальні шейкери) . Клітини Сасо-2 краще імітують кишкову проникність, ніж штучні мембрани . Попри те, що їх широко застосовують для скринінгу транспорту лікарських засобів, ця система непридатна для тестування вивільнення діючої речовини з лікарської форми.
Дослідження проникності із застосуванням Сасо-2 моношару є складними, потребують тривалої підготовки та ретельного догляду за клітинною лінією, що робить її використання доволі складним .
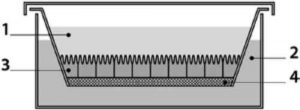
Рис. 10. Схематичне зображення системи проникності на основі клітин Сасо-2: 1 - донорна (апікальна) камера; 2 - акцепторна (базолатеральна) камера; 3 - моношар клітин Сасо-2; 4 - твердий проникний базовий мембранний шар
Наскільки нам відомо, наразі не існує комерційних апаратів для дослідження вивільнення/розчинення-проникності, які б поєднували всі функції компендіального USP2 з використанням ex vivo ТТ-мембрани . Проте інтеграція клітин Сасо-2 між донорною та акцепторною камерами відома. В системі in vitro dissolution absorption (IDAS2; рис. 11) використано моношар клітин Сасо-2 (з відносно стандартизованими властивостями), який формується на сітці із синтетичного полімеру з попередньо визначеними формами та площею поверхні, що може бути підготовлена у мікробіологічній лабораторії [53].
Активний транспорт крізь тканину кишківника людини (або тварини) не може бути повністю змодельований за допомогою мембрани Сасо-2 [54] . Основними перевагами мембран Сасо-2 є: невикористання у дослідженні тварин; відносно висока стандартизація та підвищена життєздатність у порівнянні з ex vivo тканинами . Перелік відомих допоміжних речовин для досягнення sink-умов в акцепторній камері за наявності мембран Сасо-2 дещо довший, ніж для ex vivo мембран, але все ще обмежений [55].
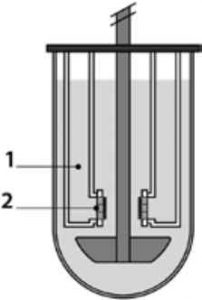
Рис. 11. Схематичне зображення системи IDAS2: 1 - камера-акцептор; 2 - шар клітин Сасо-2
За конструкцією IDAS2 відрізняється від МасгoFLUX : IDAS2 має дві невеликі акцепторні камери, а мембрани Сасо-2 розташовані вертикально без лопаті всередині . Гідродинаміка в акцепторних камерах не забезпечується . Крім того, через конструктивні відмінності, гідродинаміка в донор-ємності IDAS2 відрізняється від стандартизованої гідродинаміки компендіального USP2 та від MacroFLUX . Також у відомій комплектації IDAS2 немає пристроїв для in situ кількісного визначення речовини, але це може бути відносно легко виправлено.
Для проведення досліджень проникності ex vivo крізь ТТ-мембрани зазвичай використовують камери проникності (Ussing chambers) різної конструкції (рис. 12).
В акцепторній частині Ussing камери sink-умови можна досягти завдяки великому об'єму середовища або додаванню допоміжних речовин, що підвищують розчинність [55], але їхній вибір доволі обмежений . Використання допоміжних речовин для досягнення цієї мети (включно з поверхнево-активними речовинами) ускладнене, оскільки їхній вплив на транспорт діючої речовини та життєздатність мембрани недостатньо вивчено . Інформація щодо дифузії допоміжних речовин у напрямку від базолатеральної до апікальної поверхні мембрани також є обмеженою.
Хоча оптимальна тривалість тесту розчинення-проникності приблизно 4 год (час проходження кишківником), життєздатність мембрани ТП обмежена у часі і становить близько 90-150 хв після отримання з живого організму [56, 57] . Для підтримання життєздатності ex vivo мембрани потрібна подача кисню в середовище акцептора. Звичайна процедура підготовки ex vivo мембрани ТП передбачає видалення слизу з апікальної поверхні тканини . Це дозволяє частково стандартизувати ex vivo зразок, оскільки товщина слизового шару може варіювати між індивідами і залежати від процедури відбору . Слиз містить травні ферменти, і їхня наявність зменшує життєздатність мембрани . З іншого боку, важливість шару, що імітує слиз, уже доведено на штучних мембранах [47] . Отже, наявність слизу на апікальній поверхні ex vivo мембрани, ймовірно має аналогічний ефект . Тому, підготовку ex vivo мембрани для проведення тесту розчинення-проникності можна переглянути.
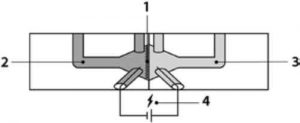
Рис. 12. Схематичне зображення камери Ussing: 1 - проникна ex vivo мембрана; 2 — донорна камера з відповідним середовищем; 3 - акцепторна камера з відповідним середовищем; 4 - система для вимірювання життєздатності мембрани (на основі TEER). Подавання кисню для підтримання життєздатності тканини та трубки для циркуляції середовища не показано
Наскільки нам відомо, на ринку наразі відсутні комерційні апарати для проведення тесту розчинення-проникності з використанням еx vivo мембран, що мають функції компендіального USP2 . Наразі розробляють GI-TRIS (GI Tissue Robotic Interface System) [58] — багатолункову систему на базі multiwell-плат із використанням ex vivo тканини свинячого ТТ для скринінгу проникності речовин . З точки зору фізіології система дуже перспективна, але їй бракує динаміки розчинення.
4. Досягнення у сфері обладнання для штучного травлення у поєднанні з проникністю
Травлення відповідає за вивільнення та перенасичення розчину діючою речовиною (тимчасова висока концентрація діючої речовини, що вища за розчинність речовини у цьому середовищі), особливо у випадку погано розчинних речовин . Це можна проілюструвати на прикладі ліполізу ліпідних рецептур або розщеплення складних цукрів (наприклад, циклодекстринів) на прості під дією ферменту амілази. Існують комерційні системи штучного травлення, такі як The Dynamic Gastric Model від Bioneer [59], але вони рідко містять компонент проникності. Вже описано системи ліполізу-проникності з використанням моношару клітин Сасо-2 [60], проте жодна з них не забезпечує умови розчинення, подібні до таких за використання компендіального USP2 .
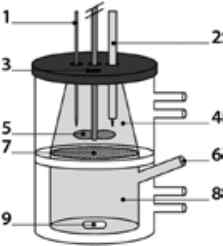
Рис. 13. Схематичне зображення системи штучного травлення-проникності: 1 - титратор (бюретка); 2 - рН-метр; 3 - порт для відбору проб (донор); 4 — камера травлення (донор); 5 — лопать; 6 — порт для відбору проб (акцептор); 7 - проникна мембрана (шар клітин); 8 — акцепторна камера; 9 - магнітна мішалка
Першою запропонованою системою ліполізу-проникності [60] (рис. 13) є двокамерна конструкція: донорна (люмінальна) камера з травним середовищем і акцепторна (приймаюча або базолатеральна) камера, розділені проникною мембраною (моношар клітин Сасо-2) . Перемішування забезпечується в обох камерах. Усю систему підключено до водяної бані для підтримання постійної температури . Верхню, люмінальну, камеру обладнано бюреткою для титрування, рН-метром і портом для відбору проб . Нижня, приймаюча, камера також має порт для відбору проб.
5. Біофармацевтичне застосування наявного обладнання для розчинення-проникності-штучного травлення
Наразі тестування розчинення-проникності здебільшого застосовують до погано розчинних речовин . Таким чином їх можна класифікувати за системою brick dust/grease balls, а також підбирати відповідне обладнання для проведення тестування. Речовини зі слабкою кристалічною решіткою та відносно високим log P (3-6) класифікують як grease balls, тоді як речовини із сильною кристалічною решіткою (висока температура плавлення) та відносно низьким log P (0-3) — як brick dust [12] .
Для поліпшення видимої розчинності, розчинення та біодоступності речовин brick dust i grease balls використовують різні підходи. Речовини grease balls можна інтегрувати у ліпідні формуляції, що підлягають або не підлягають травленню . У випадку ліпідних формуляцій, що піддаються травленню, слід ураховувати штучне травлення під час проведення тесту розчинення-проникності для отримання біорелевантних результатів . Речовини brick dust зазвичай формулюють як аморфні тверді дисперсії (ASD) із використанням полімерів . Їхнє тестування можна здійснювати за допомогою систем розчинення-проникності із використанням штучної або Сасо-2 мембрани залежно від класу ВСЅ (рис. 14) .
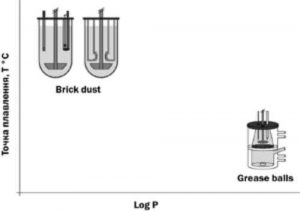
Рис. 14. Концептуальна придатність наявного обладнання для проведення досліджень розчинення та/або проникності залежно від класифікації погано розчинних речовин на brick dust або grease balls
Для тестування препаратів різних класів BCS/DCS (I, IIa, IIb, III та IV) потрібне різне обладнання та експериментальні налаштування (рис. 15) .
- BCS класу I (висока розчинність та висока проникність): можна використовувати стандартний USP2-апарат, оскільки профіль вивільнення корелює з профілем абсорбції .
- BCS класу III (висока розчинність, низька проникність) зазвичай тестують на USP2-апараті; для оцінки активного транспорту можна використовувати Сасо-2 або ех vivo мембрану .
- BCS класу II (brick dust): полімерні ASD тестують у системах розчинення-проникності крізь штучну мембрану (за потреби також Сасо-2 або ех vivo мембрани), але існують конструктивні обмеження (наприклад, малий об'єм акцепторної камери) .
- BCS класу II (grease balls): ліпідні формуляції тестують у системах штучного травлення-розчинення-проникності .
- BCS класу IV (мала розчинність і низька проникність) потребують Сасо-2 або ех vivo мембран для оцінювання впливу формуляції чи складу середовища на зміну проникності . Серед доступного обладнання для цього відомий лише IDAS2 з моношаром клітин Саco-2.
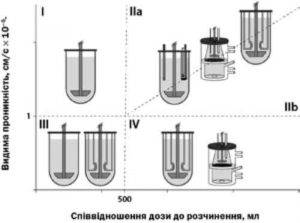
Рис. 15. Концептуальна придатність наявного обладнання для проведення досліджень розчинення та/або проникності відповідно до BCS/DCS класу
6. Висновок
Оцінювання розчинення/вивільнення лікарських засобів було однією з найважливіших перевірок пероральних форм протягом останніх десятиліть, відіграючи ключову роль у розробці формуляцій . Проте парадигма у фармацевтичній науці з часом змінилася від речовин без проблем із розчинністю у водних середовищах (клас I/III BCS) до переважання погано розчинних (клас II/IV BCS) .
Ця зміна підкреслює обмеження традиційних компендіальних тестів розчинення щодо сучасних викликів . З огляду на зміну критеріїв drugability адаптують не лише нові підходи до формулювання та технологічні форми, а й методи тестування . Оптимальне обладнання для тестування препаратів поєднує фізіологічну релевантність з простотою експлуатації . Якщо відомості лише про профіль вивільнення недостатні для оцінки in vivo, проведення тестування проникності стає критично важливим для біофармацевтичної оцінки та прогнозування фармакокінетики.
Хоча обладнання для розчинення, проникності та штучного травлення лише частково імітує розчинення та абсорбцію пероральних форм, його постійно вдосконалюють. У міру зростання потреби у наукових рішеннях ринок адаптується до вирішення проблем з розробки складу та технологій.
В огляді проілюстровано безперервну еволюцію та сучасний стан систем тестування розчинення та проникності речовин, що зумовлено зростаючою кількістю погано розчинних речовин у фармацевтичних дослідженнях . Крім того, наведено приклади використання наявного обладнання для тестування на підставі BCS і DCS.
Оригінал статті та перелік використаної літератури за посиланням:
Sitovs A, Cernisova V. Mohylyuk V. Dissolution-Permeation Systems in Biopharmaceutical Research: A Graphical Review on the Current State-of-the-Art. J Drug Deliv Sci Technol. 2025, 10.1016/j.jddst.2025.106814 https://www.sciencedirect.com/science/article/pii/S1773224725002175
Із питаннями звертайтеся: Валентин Могилюк, канд. фармац. наук (Valentyn.Mohylyuk@gmail.com)