Прослеживаемость лекарств – основной мировой тренд начала века
Начиная с первых лет XXI века ведущие страны приступили к серьезной подготовке и поэтапному введению на своей территории элемента цифровой экономики, которая получила название ЦИФРОВАЯ МАРКИРОВКА или ПРОСЛЕЖИВАЕМОСТЬ (англ. Track&Trace), хотя изначальный смысл этого термина более узкий в сравнении с тем, к которому пришла концепция прослеживаемости к 2021 г.
Стоит отметить, что на сегодня ни одна страна в мире не достигла полностью целей проекта. Полная прослеживаемость лекарственных средств (ЛС) подразумевает получение государственной (или надгосударственной) информационной системой полной картины обо всех стадиях жизненного цикла – от производства (отечественного или зарубежного) через все цепочки поставок и структуру дистрибьюции до конечной точки реализации (аптеки или медицинской организации) и, финально, до выбытия и окончания жизненного цикла препарата. Такая полная прослеживаемость не реализована пока ни в одной стране мира.
Ближе всех к этому находятся развитые, высокодисциплинированные и очень небольшие по географическому признаку экономики стран Дальнего Востока:
• Южная Корея. Проект начался в 2010 г., к 2013 система была запущена, до 2017 в нее постепенно добавляли различные группы ЛС. Изначально достигнута полная прослеживаемость (вплоть до передачи данных о ценах).
• Тайвань. В 2015 г. введена прослеживаемость на уровне партий ЛС, с 2016 по 2018 г. поэтапно внедрен поэкземплярный учет.
К ним примыкают страны с жестко регулируемой экономикой: Иордания и Саудовская Аравия, где полная прослеживаемость ЛС поэтапно введена к 2017 г. Из стран Европы первой маркировку ЛС ввела Турция (2010 – 2012 гг.).
Этот эксперимент, оказавшийся вполне успешным, явился основой для подготовки к введению маркировки ЛС в Европейском Союзе. Подготовка длилась более 10 лет и первая фаза – поштучная прослеживаемость рецептурных препаратов – была запущена во всех странах ЕС в феврале 2019 г. Впрочем, уже к маю того же года Еврокомиссии пришлось срочно вводить послабления для нескольких стран, которые не были готовы к старту. На данный момент специальные условия действуют для Италии и Нидерландов.
В том или ином объеме маркировка ЛС является обязательным требованием также в США, Индии, Китае, России, Аргентине, Чили, Египте, Бахрейне, ЮАР и еще в нескольких странах.
На финальных стадиях подготовки (старт намечен в 2022 – 2023 гг.) находятся Канада, Бразилия, Япония, Венесуэла, Колумбия, Казахстан, Беларусь, Армения, Иран, Пакистан, несколько африканских стран.
В каждом из проектов можно выделить три уровня прослеживаемости:
• Прослеживаемость партий (серий) ЛС.
• Прослеживаемость каждой индивидуальной упаковки ЛС от момента ввода в оборот до выбытия.
• Полная прослеживаемость, включая передачу агрегационных кодов и контроль всей цепочки поставок.
В зависимости от особенностей экономики и внутренних правил последовательность введения этих уровней разнится. В азиатских странах маркировку начинали с учета партий, прослеживаемости партий и серий. А весь опыт Европы и США говорит о том, что важнее начать прослеживать каждую индивидуальную упаковку. При этом вначале – только момент производства (ввода в оборот) и вывода из обращения (продажи или использования в медицинском учреждении).
Зачем государствам нужна прослеживаемость?
Фармацевтика всегда была и остается одной из самых социальнозначимых отраслей промышленности. Кроме того, регуляторика в этой отрасли является одной из самых жестких, ее можно сравнить, пожалуй, только с контролем над производством вооружения.
И тем не менее каждая страна сталкивается с серьезными вызовами и нарушениями. В зависимости от того, какие нарушения преобладают, страны выбирают сценарии маркировки и уровень государственного контроля за этой системой. Например:
• Основной проблемой в Индии является подделка ЛС тысячами подпольных цехов. И несмотря на то что эти подделки не всегда некачественные, они точно угрожают престижу страны, поскольку демонстрируют нарушения в области патентов и автор-ских прав, да и эффективность поддельных препаратов не доказана. Поэтому на первом этапе (2019 г.) в Индии была введена обязательная маркировка экспортной продукции и ее полная прослеживаемость. Следует отметить, что внутренний рынок страны пока не охвачен системой прослеживаемости.
• Вопросы попадания на рынок контрафактной продукции волновали как Турцию, так и страны Европы. При этом речь идет не о внутреннем производстве, а скорее о ввозе неразрешенных к использованию партий препаратов, обращении ЛС, которые должны быть выведены из оборота. Еще более значимым явился «переток» ЛС из более бедных стран ЕС (где лекарства дешевле) в более состоятельные страны. И это скорее не угроза попадания некачественных препаратов, а сугубо экономические причины и угроза ценовых войн,
демпинга, передела сфер влияния. Отсюда и модель – контроль индивидуальных упаковок ЛС с упором на контроль точек выбытия. Поставленные в страну препараты должны реализовываться именно в этой стране.
• В странах бывшего Советского Союза совершенно другие проблемы и соответственно разные задачи систем маркировки. В этих странах основную угрозу представляет «переток» ЛС из больниц в розницу. Почему? БОльшая часть медицинских организаций в этих странах остается государственной. Закупка ЛС происходит за государственные бюджетные средства. Злоупотреблением является передача данных ЛС для реализации в розницу с последующим хищением вырученных средств, то есть по сути происходит расхищение государственного бюджета, выделенного на медицину. При этом в каждой из этих стран государство является не просто «контролером», оно – крупнейший игрок на рынке. Большинство медицинских учреждений находятся в государственном подчинении.
Таким образом, модели построения систем прослеживаемости ЛС значительно отличаются – от полного отстранения государства от управления в Европе (потери денег – дело корпораций, государство зачастую вынуждено покупать данные о движении ЛС по своей территории у аналитических агентств) до полного контроля движения препаратов в Китае, России или Индии, поскольку именно государство там является
крупнейшей корпорацией (или, как в Индии, страдает его международный престиж), и именно оно теряет деньги от злоупотреблений.
Опыт внедрения
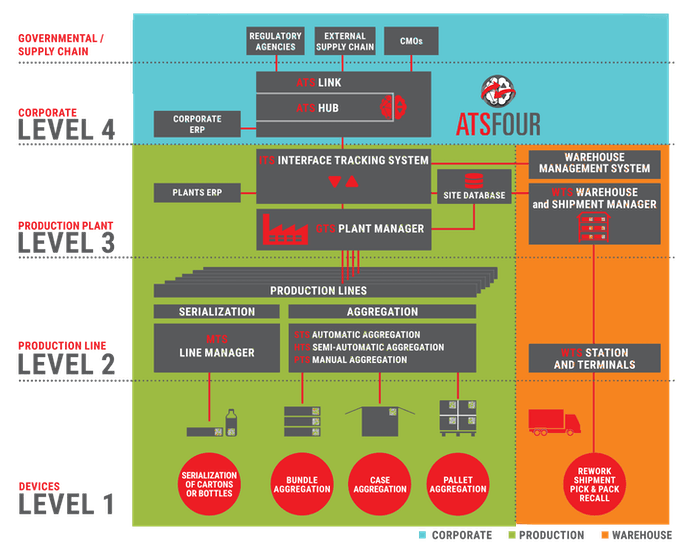
Какими бы ни были глобальные цели построения систем маркировки и прослеживаемости в каждой отдельной стране, первыми все равно страдают производители ЛС. Для того чтобы система маркировки начала функционировать в любом виде, ЛС должны быть маркированы, а точнее – сериализованы. Это значит, что на каждую вторичную упаковку препарата (а при ее отсутствии – на первичную) должен быть нанесен индивидуальный код. Причем в соответствии с жесткими требованиями GMP и с учетом регуляторных ограничений ЛС должны быть маркированы именно на заводе-производителе (точнее – на предприятии, которое осуществляет финальную фазу производства и упаковку) независимо от того, собственное это производство или контрактное. Это означает, что каждое предприятие в стране должно быть оснащено оборудованием и информационной системой для создания такого кода по заданной методике, его обработки, нанесения на упаковку и учета операций с маркированной упаковкой:
• завершения процесса упаковки;
• учета отбора образцов и архивных экземпляров;
• ввода в оборот;
• отгрузки в канал продаж и передачи всех этих данных в государственную информационную систему. Это минимальные требования. Если не нужна агрегация, то операции этим можно и ограничить. Если же агрегация требуется, то к вышеперечисленному добавляется еще полдюжины операций.
При этом опыт компании Antares Vision показывает, что трудоемкость данных процессов не зависит от страны внедрения.



