 Петро Шотурма,
Петро Шотурма,
аудитор, експерт із питань GMP, компанія «Метод Фармацевтичний Консалтинг»
Інвестор, який планує побудувати новий завод із виробництва лікарських засобів, розраховує на повернення інвестицій та отримання прибутку в майбутньому. На якому етапі проведення кваліфікації проєкту буде ефективним, щоб підготувати надійний фундамент, аби підприємство відповідало вимогам GMP та очікуванням інвестора? Спробуємо розібратися у цьому проблемному питанні на прикладі двох проєктів біотехнологічного напрямку. Через конфіденційність прибрано ідентифікатори компанії, проєктної організації та назви препаратів.
Для зручності використано терміни та визначення, наведені після основного тексту статті.
Кваліфікація проєкту (DQ), розширений огляд проєкту (EDR) або експертиза проєкту на відповідність стандартам GMP – за своєю суттю це назви однієї й тієї самої діяльності експерта або групи експертів щодо виявлення ступеня відповідності проєкту вимогам GMP, пов’язаних із нормативними документами та очікуваннями інвестора.
Розглядаючи життєвий цикл проєктування підприємства, виділимо п’ять важливих етапів:
- бізнес-план та feasibility study (аналіз можливості реалізації проєкту);
- концептуальне проєктування заводу;
- проєктування;
- розробка робочого проєкту та робочої документації;
- будівництво чи реалізація проєкту.
Важливо провести кваліфіковану експертизу на етапі концепту або навіть на етапі попереднього планування в рамках feasibility study (тобто на ранніх етапах проєкту і що раніше, то дешевше інвестору обійдеться усунення недоліків), тобто після 1-го та 2-го етапу життєвого циклу проєкту.
Останні два проєкти, представлені для проведення експертизи, були вже на його робочому етапі (тобто старту фази будівництва, коли загальні будівельні роботи вже розпочалися).
Біотехнологічний проєкт несе виклики та становить певні складнощі для інвесторів і проєктних менеджерів під час проєктування сучасних підприємств, орієнтованих як на внутрішній ринок України, так і насамперед на експорт.
Перший проєкт, використаний для прикладу, – новий завод із виробництва вакцин для застосування у ветеринарії, а також препаратів для ветеринарної практики з хімічних субстанцій (для кожної форми виділено свої лінії). Місце будівництва – Україна. Передбачено виведення продукції на експорт.
Кваліфікація проєкту є особливо актуальною для ветеринарного виробництва, яке за рівнем регулювання та державного нагляду в Україні «відстає» від виробництва ліків для людей. Але в інших країнах, включаючи країни ЄС, це рівень GMP без жодних винятків.
Другий проєкт, використаний для прикладу, – новий завод із виробництва субстанції для вакцини, один набір технологічного обладнання в одному цеху. Місце будівництва – Казахстан.
Обидва проєкти були пов’язані з біотехнологічним виробництвом: вакцин як готової лікарської форми (1-й проєкт) та субстанцій для вакцин (2-й проєкт).
Процес підготовки звіту про кваліфікацію проєкту
Першим кроком важливо ідентифікувати всі нормативні документи та керівні вказівки, які застосовують для субстанції або лікарської форми, що планується до випуску.
В компанії «Метод Фармацевтичний Консалтинг» це завдання вирішено за рахунок застосування стандартизованих шаблонів-запитань. Під час підготовки протоколу кваліфікації проєкту використовують один чи кілька опитувальників. Це полегшує початок роботи та знижує ризик помилок, оскільки дотримання деяких вимог може бути ускладнене під час проведення експертизи проєктної документації.
Складання експертного звіту в довільній формі без урахування усіх вимог є поганою практикою, оскільки, розглядаючи проблемне питання, експерт може зосередитися на ньому та випустити з поля зору невиконання інших, не менш важливих вимог.

Найчастіше вимоги, наведені в Правилах GMP, формулюються мовою, що відрізняється від мови технічного стандарту, і не завжди бувають технічно чіткими та вичерпними. Перекласти вимоги на мову предметної області та інтерпретувати їх максимально повно і грамотно є завданнями експертної групи DQ. Щоб зробити таку інтерпретацію, експертна група повинна мати великий практичний досвід, а також навики проєктування та аудиту подібних підприємств.
Враховуючи географію експорту, використовують, за наявності, міжнародні стандарти (наприклад, ISO) та інші, визнані на міжнародному рівні правила GMP і керівні вказівки ISPE.
Ризики та виклики 1-го проєкту
Проєкт характеризується багатономенклатурним виробництвом: на одній території зосереджено цехи з виробництва субстанцій для вакцин, готових лікарських форм, вакцин для застосування у ветеринарії, а також випуску препаратів з хімічних субстанцій. Біологічна лабораторія потребує побудови комплексу приміщень для досягнення відповідності рівню BSL-3. Передбачено використання клітинного та вірусного матеріалу II групи безпеки (BSL-3 згідно з Директивою 2000/54/ЄС).
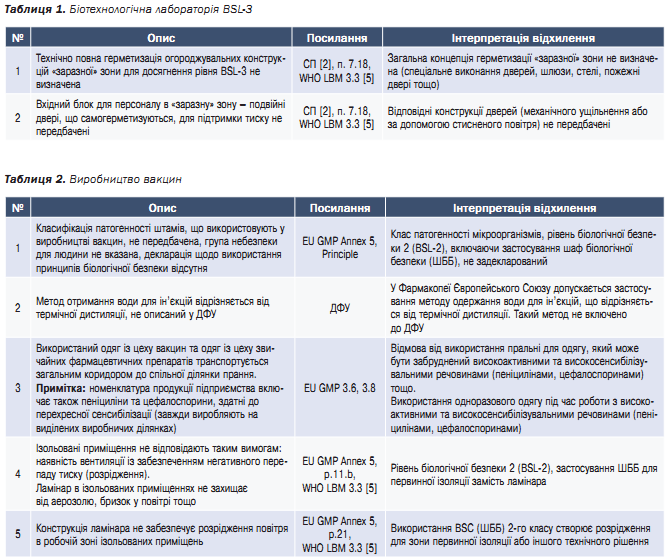
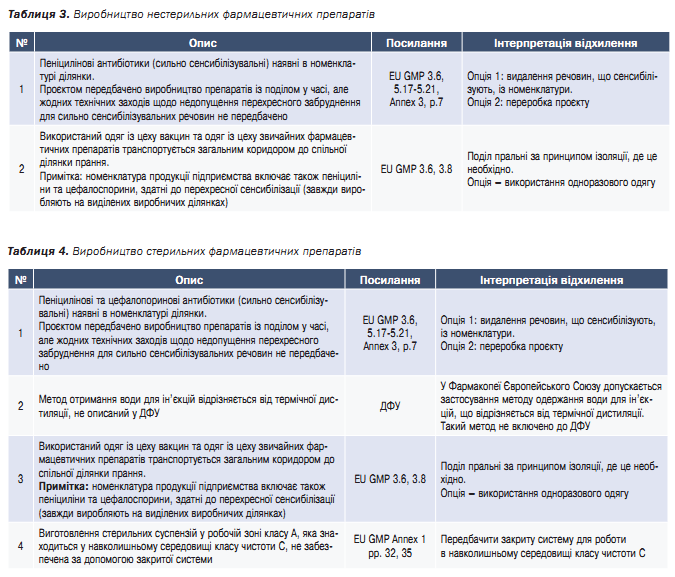
В таблицях 1–4 наведено найкритичніші невідповідності проєктних рішень (проєктної документації) 1-го проєкту.
Висновок: допущено декілька критичних помилок, не враховано принципи біологічної безпеки ВООЗ і вимоги GMP. Виявлено відхилення, які критично впливають на відповідність проєкту вимогам GMP та WHO LBM, які висуваються до виробництва імунобіологічних АФС (для вакцин) та самих вакцин. Неприпустимі для спільного виробництва бета лактамні антибіотики та препарати звичайної номенклатури. Без усунення відхилень такого рівня неможливо підтвердити відповідність проєкту вимогам для виробництва імунобіологічних АФС.
Ризики та виклики 2-го проєкту
Проєкт характеризується лише однією субстанцією, яка потребує побудови комплексу приміщень для відповідності рівню BSL-3. Передбачено використання клітинного та вірусного матеріалу II групи безпеки (BSL-3 згідно з Директивою 2000/54/ЄС).
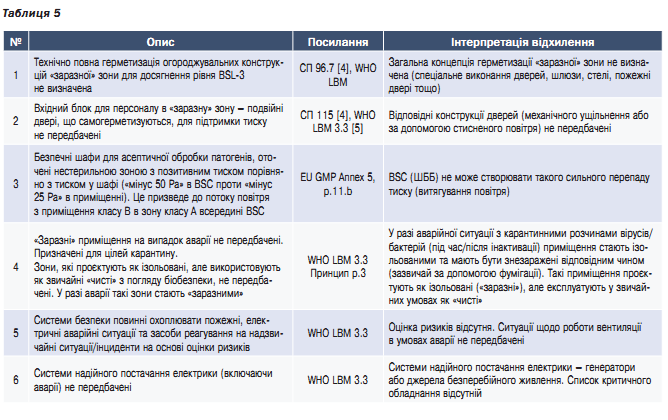
В таблиці 5 наведено найкритичніші невідповідності проєктних рішень (проєктної документації) 2-го проєкту.
Висновок: допущено декілька критичних помилок, не враховано принципи біологічної безпеки та вимоги GMP. Виявлено відхилення, які критично впливають на відповідність проєкту вимогам GMP і WHO LBM для виробництва імунобіологічних АФС (для вакцин). Без усунення відхилень неможливо підтвердити відповідність проєкту вимогам, які висуваються до виробництва імунобіологічних АФС.
Чи можливо щось зробити з документацією проєктів, що містить критичні помилки щодо відповідності GMP та порушення принципів біологічної безпеки? Почати з переробки концептуального проєкту, витративши гроші та нерви і втративши дорогоцінний час, подовжуючи тривалість виходу продукції на ринок. Досвід експерта вартий того, щоб ним скористатися і зберегти час, гроші та нерви інвестора на довгі роки життєвого циклу підприємства, яке функціонуватиме протягом десятків років.
Продовження статті – у наступному номері. Будуть наведені рекомендації щодо проєктування біотехнологічного виробництва та концепція біологічної безпеки.


