Продовження. Початок у № 1 (94)
 Інвестор, який планує побудувати новий завод із виробництва лікарських засобів, розраховує на повернення інвестицій та отримання прибутку в майбутньому. Який етап проведення кваліфікації проєкту буде ефективним, щоб підготувати надійний фундамент, аби підприємство відповідало вимогам GMP та очікуванням інвестора?
Інвестор, який планує побудувати новий завод із виробництва лікарських засобів, розраховує на повернення інвестицій та отримання прибутку в майбутньому. Який етап проведення кваліфікації проєкту буде ефективним, щоб підготувати надійний фундамент, аби підприємство відповідало вимогам GMP та очікуванням інвестора?
У першій частині статті наведено приклади виявлених невідповідностей двох проєктів біотехнологічного напрямку. В продовженні статті надано практичні рекомендації щодо проєктування та опис концепції біологічної безпеки, яку застосовують спільно з правилами GMP.
Для зручності використані терміни та визначення винесено після основного тексту статті.
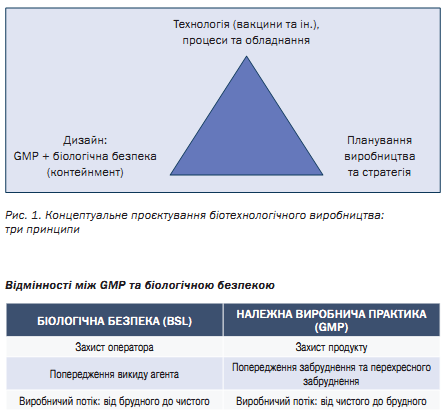
Поєднати GMP та BSL
Проєктуючи виробництво вакцин або інших імунобіологічних продуктів, необхідно дотримуватись принципу «трикутника вимог» (рис. 1). При цьому принципи біологічної безпеки можуть суперечити вимогам GMP.
Поєднати вимоги GMP та біологічної безпеки (а почасти і біологічного захисту) є ключовою задачею проєктної організації.
Рекомендації щодо біотехнологічного проєктування у разі роботи з патогенними мікроорганізмами:
1) провести аналіз ризиків визначення рівня біологічної безпеки (BSL). Такий аналіз повинен
включати використовувані віруси (група патогенності чи група ризику, I–IV), пропоноване обладнання (закрите/відкрите) та процедури роботи з вірусами;
2) системи безпеки мають охоплювати пожежні, електричні, аварійні ситуації та засоби реагування на надзвичайні ситуації/інциденти на основі оцінки ризиків;
3) проєктувати використання закритих систем, де це можливо. Для закритих систем існують
свої підходи до захисту продукту та біоконтейнменту; для відкритих систем застосовують більш
суворі підходи до захисту продукту та біоконтейнменту;
4) декларувати та підсумовувати технічні рішення, запропоновані в ході проєктування, в частині ізольованих/заразних приміщень (contained area). Концепція розмежування потоків на «заразні» зони та «чисті» зони.
Робота з небезпечним патогеном передбачає застосування сучасних ізоляторних технологій або систем первинної ізоляції, а також закритих систем для переміщення патогену (рис. 2). В історичному контексті відбувається заміщення засобів індивідуального захисту технічними засобами первинного та вторинного контейнменту. Пріоритетними є саме технічні засоби первинного контейнменту.
Поєднати надлишковий тиск із розрідженням (GMP vs BSL)
Робота з небезпечним патогеном передбачає застосування засобів первинного контейнменту: шаф біологічної безпеки, що слугують як «бокс» і створюють деяке розрідження повітря, яке іноді називають «негативним тиском повітря порівняно з таким у приміщенні, в якому вони встановлені». Зони, де робота з патогеном потребує негативного тиску, є окремим викликом на етапі проєктування. Одним із найбільш вагомих ризиків розрідження (вакууму) є інфільтрація чи просочення брудного повітря в асептичні зони, де вкрай важливо підтримувати особливо чисті умови. Може бути прийнятним створення навколо такого приміщення «поясу безпеки» у вигляді «чистих приміщень» аналогічного класу чистоти. Іншою опцією є тиск «нуль» у зоні роботи з патогеном, а тиск навколишніх приміщень є вищим.
Забезпечення асептичних маніпуляцій вимагає застосування шаф біологічної безпеки без рециркуляції повітря (тип 2В). Альтернативні рішення – ізолятор закритого типу в оточенні приміщення класу чистоти С або шаф біологічної безпеки 3-го класу.

Рис. 2. Приклад сучасного рішення щодо роботи з вірусом
у закритій системі (біоконтейнмент)
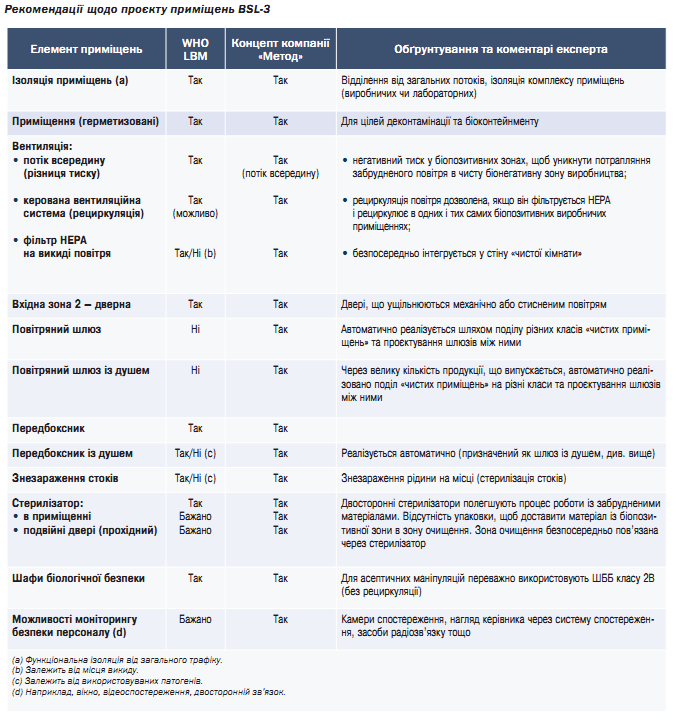
Огляд вимог до BSL-3 та підхід компанії «Метод» до проєктування
Приміщення рівня BSL-1 та BSL-2 – найпоширеніші у світі. Застосування приміщень BSL-4 є прерогативою держави з огляду на надзвичайно високий ризик під час роботи зі смертельно небезпечними патогенами, ризик викиду в атмосферу чи крадіжки патогену зловмисниками для виробництва біологічної зброї тощо.

Приміщення BSL-3 використовують також для роботи з патогенами вірусу SARS-CoV-2 під час виробництва субстанцій та асептичного наповнення вакцин. Основними відмінностями цих приміщень є концепція герметизації, застосування централізованих систем знезараження, спеціальних деконтамінаційних шлюзів тощо.
Резюмуючи, варто акцентувати увагу на тому, що розробляти концептуальний проєкт мають компетентні фахівці у предметній галузі, а відділ забезпечення якості (QA) фармацевтичного виробництва має створити умови для проведення експертизи проєкту (за необхідності – із залученням консультантів) та відігравати принципову роль у створенні специфікації вимог користувача на проєкт (технічного завдання), вибору та оцінки постачальника послуг з кваліфікації проєкту, процесу приймання та кваліфікації обладнання/систем
для цілей проєкту.
Продовження читайте у pdf-файлі нижче


