Александр В. Александров,
руководитель Группы компаний «ВИАЛЕК», ведущий аудитор Европейской организации качества (EOQ), консультант, тренер по GMP/GDP
В сфере обращения лекарственных средств нужно быть уверенным в качестве не только своего продукта, но и используемых сырья и материалов, оказываемых аутсорсинговых услуг (например, перевозка и хранение лекарственных средств), оборудования, расходных материалов, реактивов и пр. Выбор, оценка, квалификация и одобрение поставщиков – это прямое требование правил GMP/GDP.
Например, пункт 1.4 (vi) Части 1 GMP [1] устанавливает: «… фармацевтическая система качества должна гарантировать, что приняты меры по ВЫБОРУ и МОНИТОРИНГУ поставщиков, обеспечивающие соответствие производства, поставок, использования сырья и упаковочных материалов установленным требованиям». Аналогичное требование содержится в пункте 5.27 Части 1 GMP: «… наряду с закупками и приемкой должны документально оформляться ВЫБОР, КВАЛИФИКАЦИЯ, ОДОБРЕНИЕ и ПОДДЕРЖАНИЕ СТАТУСА поставщиков исходных материалов. Для каждого одобренного поставщика/ материала должны быть собраны подтверждающие свидетельства. Необходимо поддерживать актуальные знания о поставщиках, цепочках поставок и связанных с ними рисках. Предпринимаемые усилия следует соотносить с риском, связанным с использованием материалов».

Получается, всех поставщиков условно можно разделить на три категории: поставщики критических позиций, поставщики важных позиций и другие поставщики (рис. 1) и на основании этого выбрать подходящую (для каждого из них) модель квалификации и одобрения исходя из способности заказчика удерживать под контролем риски для качества. Тогда для одобрения одних поставщиков потребуется аудит, для других – решение может быть принято после изучения доступной о них информации, текста предоставленного руководства по качеству, мастер-файла и (или) путем признания сертификатов, подтверждающих соответствие деятельности поставщика требованиям тех или иных стандартов (ISO 9001, ISO 13485, ISO 17025, ISO 22000 и т.п.) (рис. 2).
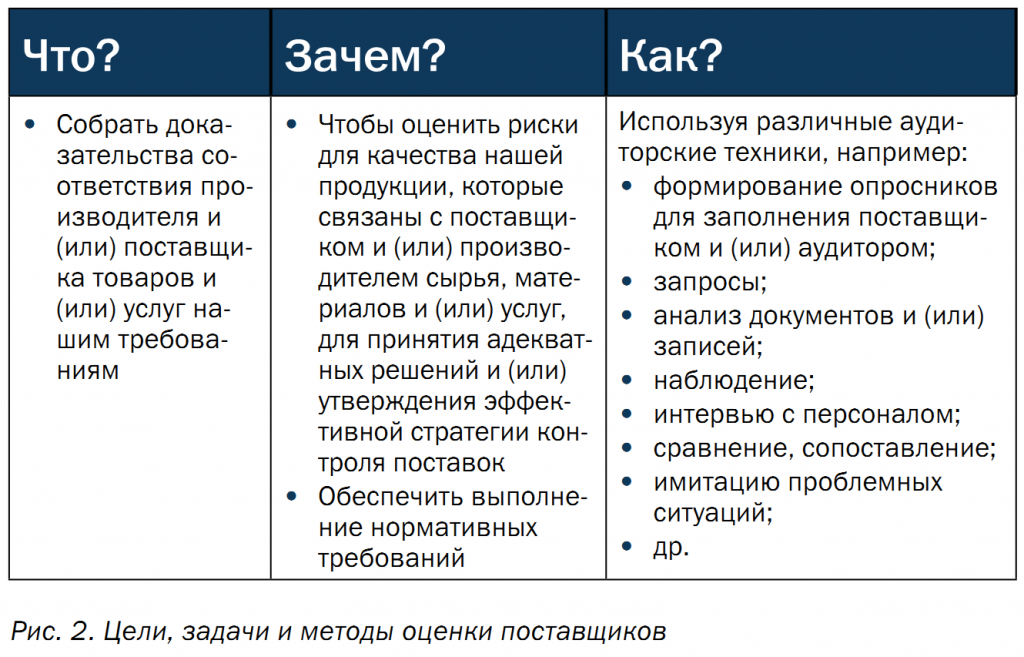
Существуют разные техники и тактики оценки, квалификации и одобрения поставщиков. В правилах GMP нет указания на то, как правильно это делать. Выбор всегда остается за организацией, которая проводит аудит. В то же время в таких вопросах есть множество граней.
Данная статья посвящена обсуждению возможности проведения заочного аудита поставщиков критических и важных позиций и определению его достаточности для квалификации и одобрения поставщиков с учетом действующих требований GMP. Под поставщиком в статье понимаются все участники цепочки поставок (собирательный термин): производители, дистрибьюторы, посредники, представители сервисных организаций, осуществляющие хранение и транспортировку продукции. Если в контексте это имеет значение, упоминается конкретный субъект (например, производитель и (или) дистрибьютор).
Если вернуться к требованиям GMP, то в пункте 5.29 Части 1 GMP установлено: «… для одобрения и поддержания статуса поставщиков активных фармацевтических субстанций (АФС) должны проводиться АУДИТЫ производителей и дистрибьюторов АФС для подтверждения их соответствия требованиям GMP/GDP. Вспомогательные вещества и их поставщики должны контролироваться на основе результатов формализованной оценки рисков для качества» [2]. Тот же вывод (о необходимости аудита) можно сделать в отношении поставщиков упаковочных и печатных материалов (пункт 5.45 Части 1 GMP; пункт 5 Приложения 8 GMP), аутсорсинговых услуг (7.4 – 7.5 Части 1 GMP) и программного обеспечения
(пункт 3.2 Приложения 11 GMP). Дополнительно может потребоваться аудит поставщиков других материалов, таких как моющие и дезинфицирующие средства; стерилизуемая бумага для протоколов, стерильные ручки и маркеры для использования в зоне класса чистоты А/В; защитная одежда для «чистых помещений»; стерилизующие фильтры и пр. – всего того, в отношении чего инспекторы просят предоставить гарантии качества.
Однако в правилах GMP не установлен формат аудита.
Аудит бывает документарный (paper-based), удаленный (дистанционный) и очный (рис. 3). Первые два формата часто называют заочными. Заочный аудит – быстрый и дешевый; очный – с одной стороны, как бы надежный, красивый, но с другой – точно более затратный (рис. 4). Сегодня, в эпоху развития новых информационно-коммуникационных технологий, каждый формат позволяет достичь поставленной перед аудитом цели. Здесь разницы нет. Скорее, это вопрос компетентности, «насмотренности» и современности аудитора. Когда и какой вид аудита применить для оценки поставщика – это вопрос со множеством переменных. Заочный аудит не уступает по преимуществам аудиту на месте. У заочного более высокий потенциал в обеспечении гибкости аудита, но и пока остается вопрос о признании его результатов со стороны уполномоченных органов в ходе
инспекций на соответствие требованиям GMP/GDP.
Следует учесть и тот факт, что аудит может быть смешанным – часть доказательств соответствия собирают в ходе докумен-тарной проверки, часть – в ходе удаленного взаимодействия и часть, если нужно, на площадке поставщика.
Что такое аудит? Аудит – это вид деятельности, заключающийся в сборе и оценке фактов в отношении функционирования того или иного объекта, и осуществляемый компетентным независимым лицом, которое, исходя из установленных критериев, делает вывод (формулирует заключение) о соответствии объекта тем или иным требованиям. Методики аудиторских проверок, дистанционных и проводимых непосредственно на месте, регламентируют-ся разными международными стандартами (например, ISO 19011:2018 [3] или методические указания ВОЗ [4] по организации удаленных проверок), но чаще всего более детализированными внутренними процедурами системы качества. Каждый аудитор использует свой набор аудиторских техник под конкретную задачу (рис. 5) как по отдельности, так и в комбинации.



