Як правильно скласти Специфікацію вимог користувача, щоб створити надійний фундамент, а обладнання/система для водопідготовки відповідали вимогам GMP? Спробуємо розібратися у цьому проблемному питанні.

Петро Шотурма, аудитор, уксперт із питань GMP та технологій виробництва ЛЗ
Будемо дотримуватися способу підготовки аналогічного документа для іншого обладнання та систем, тому рекомендації стануть корисними для інжинірингової діяльності у цій галузі — закупівлі обладнання/систем для фармацевтичного підприємства. Для зручності використані терміни та визначення винесені після основного тексту статті.
Специфікація вимог користувача (інші назви: «Технічне завдання», URS) є документом, який зазвичай використовують для визначення вимог і очікувань користувача від кінцевого продукту. Під кінцевим продуктом треба розглянути як окремі одиниці обладнання, так і зв’язки між ними та програмне забезпечення, яким має бути укомплектована система в рамках проєкту, що реалізується.
URS є відправною точкою для виконання кваліфікації проєкту, коли документально підтверджено, що запропонований проєкт системи для водопідготовки є придатним для застосування за призначенням та відповідає вимогам GMP [1]. Це означає, що завершальним етапом фази проєктування є перевірка повної відповідності всім вимогам URS і специфікацій, отриманих від постачальника. Усі вимоги URS повинні бути простежуваними у Функціональній специфікації (FDS) та детальних специфікаціях проєкту (DDS).
Схематично взаємозв’язок етапів створення проєкту та валідації розроблено робочою групою GAMP. Він більш відомий як «V-подібна схема валідації» (рис. 1).
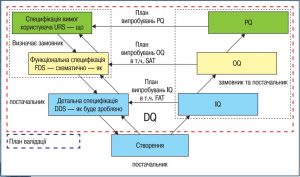 Дана схема є робочою, але ще у2007 р. було застосовано більш прогресивні підходи, наприклад у Настанові ASTM E2500 «Стандарт-на настанова для розробки специфікації, проєктування та верифікації фармацевтичних і біофармацевтичних виробничих систем та обладнання» [4]. ASTM E2500 пропонує оптимізацію часу та коштів на перевірку, тестування та кваліфікацію обладнання та систем.
Дана схема є робочою, але ще у2007 р. було застосовано більш прогресивні підходи, наприклад у Настанові ASTM E2500 «Стандарт-на настанова для розробки специфікації, проєктування та верифікації фармацевтичних і біофармацевтичних виробничих систем та обладнання» [4]. ASTM E2500 пропонує оптимізацію часу та коштів на перевірку, тестування та кваліфікацію обладнання та систем.
Після збору необхідної інформації щодо якості води та способів її отримання постає необхідність документально оформити замовлення системи для водопідготовки у вигляді URS. Спочатку його потрібно надіслати потенційним постачальникам, а потім документ має стати частиною контракту на постачання у вигляді додатка.
Розглянемо юридичну сторону питання взаємовідносин замовника та виконавця.
Замовник (офіційний термін, який є аналогічним терміну «користувач») не може вимагати відповідності системи для водопідготовки нічому іншому, крім URS. У той же час виконавець (постачальник або виробник) не може заявляти, що система готова, якщо вона не відповідає всім вимогам URS. Документ також стане основою для визначення вартості, планування, створення графіків постачання, етапів, плану тестування (приймання та кваліфікації) тощо. Тому всі зацікавлені сторони контракту повинні переконатися, що всі необхідні елементи, функції та опції ретельно опрацьовані й зрозумілі сторонам.
Створення URS потребує узгодженої роботи, щоб переконатися, що вона є технічно й економічно доцільною. Підготовка URS є однією з тих навичок, яка перебуває на межі науки та мистецтва, що потребує як технічних навичок, так і досвіду міжособистісного спілкування.
Найчастіше вимоги, які висуває користувач, формулюють мовою споживача-нефахівця, тому вони не завжди бувають технічно чіткими та вичерпними. Перекласти вимоги на мову предметної галузі, сформулювати завдання максимально повно і грамотно, обґрунтувати необхідність його вирішення є головними цілями під час підготовки функціональної специфікації. Постачальник має виконувати цей переклад у тісному контакті із замовником.
Процес підготовки URS
Як перший крок важливо персонально ідентифікувати фахівця-експерта (SME), який представляє кінцевих користувачів водопідготовки. Ця людина є первинною контактною особою та координатором проєкту з організації учасників підготовки URS, яка допоможе в ідентифікації ресурсів і груп, що братимуть участь у процесі інтерв’ю, та полегшить планування цих інтерв’ю.
Також роль координатора проєкту полягає в тому, щоб чітко визначити, хто буде рецензентом і затверджуватиме документовану специфікацію URS. Ролі та обов’язки фахівців-експертів, які беруть участь у підготовці URS, мають бути чітко зазначені в самому документі. У документообігу URS можна назвати такі ролі: розробник шаблона URS; розробник(и) змісту URS; рецензент із питань валідації та GAMP; рецензент формату (зазвичай цю роль виконує QA); адміністратор URS.
Вкрай важливо, щоб сфера застосування, яка буде охоплена в URS, була чітко визначена та узгоджена. Межі та винятки у секціях функціональності, даних, інтерфейсу та навколишнього середовища мають бути чітко визначені та документовані. Щоб правильно визначити сферу, автор(и) URS має(ють) послуговуватися такими документами, як проєктні пропозиції, формалізоване технічне завдання, комерційні пропозиції, концептуальні проєктні документи, та іншими джерелами, якщо це можливо, а також обговорювати зміст документа з координатором проєкту або цільовим(и) власником(а-ми) майбутньої системи для водопідготовки.
На етапі розроблення шаблона URS рекомендовано врахувати, що потенційні постачальники можуть володіти мовою, тому для прочитання URS їм знадобиться англійська версія документа. З урахуванням мови користувача, мови документації користувача, мови постачальника, мови контракту (юридичні аспекти) доцільно розробляти мультимовні документи, наприклад українсько-англійські (табл.1).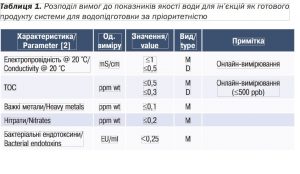
Підготовка опитувальних листів та проведення інтерв’ю
Координатору URS бажано підготувати опитувальні листи для проведення інтерв’ю:
- сформулювати питання, пов’язані із розділами URS;
- надіслати опитувальні листи всім учасникам;
- запланувати та провести робочі зустрічі;
- підсумувати всю отриману інформацію (і внести її у відповідний шаблон URS).
Для того щоб інтерв’ю було ефективним та повним, готують опитувальні листи. Анкети повинні містити питання, пов’язані з усіма основними розділами URS, як це визначено в шаблоні документа. Анкети також мають бути адаптовані залежно від ролі/завдань, що виконують особи, які беруть участь в інтерв’ю.
Координатор проєкту може розглянути питання про направлення опитувальних листів для підтвердження розкладу інтерв’ю, що дозволить фахівцям краще підготуватися та, можливо, зібрати документи, які б могли бути використані як посилання.
Проведення інтерв’ю
Процес інтерв’ю може також набути форми мозкового штурму підчас робочих зустрічей. У такому разі документ, зокрема порядок денний засідання та довідкову інформацію, необхідно підготувати та розіслати учасникам дискусії в організованому порядку.
Коли мають бути опитані спеціалісти, які виконують ті самі функції, наприклад оператори та керівники того самого виробничого відділу, з цими особами рекомендовано проводити інтерв’ю у групі. Анкети можна використовувати для усіх інтерв’ю. Під час робочих зустрічей координатор повинен робити нотатки, щоб дискусія була належним чином документована. Протокол засідання, який представляє резюме вимог, висловлених під час інтерв’ю, має бути наданий всім опитаним учасникам, аби переконатися у відсутності хибної інтерпретації вимог. Учасникам можуть бути надані до даткові питання, щоб доповнити або підтвердити отриману інформацію.
Після інтерв’ю координатор на-дає URS на рецензію та затвердження. Для цього він має:
- направити документ на рецензію згідно з процедурою документообігу компанії;
- дати рецензентам достатньо часу;
- отримати письмово усі зауваження та коментарі;
- направити документ на затвердження;
- зберегти підписані документи;
- вести контроль змін документа.
Проєкт документа необхідно направити на розгляд згідно зі списком рецензентів (з урахуванням політики документообігу організації). Всім рецензентам потрібно достатньо часу, щоб завершити процес розгляду та подати зауваження, доповнення чи коментарі. Необхідні зміни чи коментарі мають бути подані у письмовій формі або офіційно оформлені автором(ами) у разі, коли зміни/коментарі висловлені усно. Для обговорення запропонованих змін або коментарів можуть знадобитись додаткові зустрічі.
Наприкінці періоду розгляду проєкту автор повинен включити узгоджені зміни та коментарі та подати фінальну версію URS у друкованому вигляді всім особам, що затверджують URS. Слід зазначити, що URS буде предметом перегляду протягом усього циклу виробництва обладнання і, отже, має бути здійснено контроль за змінами.
Усі офіційні копії документа URS із підписом осіб, що його затвердили, мають бути збережені.
Необхідно відзначити, що власники бізнесу та керівники компанії відіграють ключову роль у затвердженні документа з огляду на забезпечення ресурсами. Типові питання, відповіді на які бажано узгодити з керівництвом: цілі і завдання; очікувані переваги; бюджет та ресурси; час, безпека, рамки обслуговування; наявні інфраструктура, політика та практики; контракт і сервісне обслуговування.
Резюмуючи процес підготовки, буде не зайвим акцентувати увагу на тому, що розробляти URS мають компетентні фахівці, але відділ забезпечення якості (QA) фармацевтичного виробника повинен забезпечити належний документообіг та відігравати принципову роль під час:
- створення специфікації вимог користувача, зокрема підписання перед затвердженням;
- вибору та оцінки постачальника обладнання/системи;
- процесу приймання та кваліфікації обладнання/системи.
Пріоритетність вимога до категорії вимог
Часто URS включає пріоритет для кожної потреби. Типова система пріоритетів може виглядати так:
- «М» (англ. — must) — обов’язкова вимога. Ця функція має бути запропонована обов’язково.
- «D» (англ. — desired) — бажана вимога. Ця функція має бути, якщо вартість не надто висока.
- «O» (англ. — option) — додаткова вимога або опція. Необов’язкові вимоги, рекомендовані технічні рішення.
- «S» (англ. — supplier) — постачальник проводить детальну оцінку параметра та пропонує рішення, що будуть враховані в наступних версіях специфікації.
- «E» (англ. — extention) — можливе розширення в майбутньому.
Приклад розподілу вимог до показників якості води для ін’єкцій як готового продукту системи для водопідготовки за пріоритетністю (див. табл. 1).
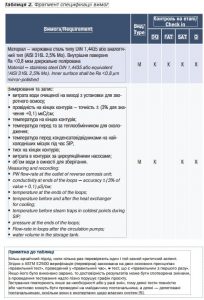
Нижче наведено приклад таблиці вимог із зазначенням етапу приймання та кваліфікації, на якому ці вимоги будуть перевірені чи проконтрольовані постачальником і замовником (табл. 2).
Отримання пропозиції від постачальника та відстеження вимог
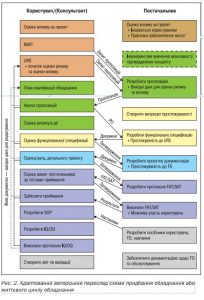
Врегулювання схеми взаємовідносин замовника (користувача) та постачальника є важливим завданням. У професійній спільноті в рамках робочої групи JETT розроблено схему придбання обладнання (рис. 2).
Матриця простежування
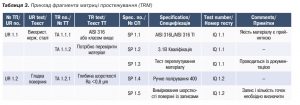
Для спрощення та більш чіткого впорядкування та порівняння вимог користувачів (UR/ТП) і технічних характеристик (TR/ТТ) може бути використана проста матриця простежування [3]. Простежування характеризується послідовним порівнянням вимог користувача, специфікаціями та способами тестування. Матриця простежування дає можливість простежити перехресні посилання між заданими елементами(простежування). З цією метою вимоги користувачів мають бути позначені унікальними номерами, щоб на них можна було посилатися.
Для кожної вимоги користувача (UR) має бути запропоновано принаймні одну технічну вимогу(TR). Це співвідношення становить1:n. Для кожної вимоги (специфікації користувача) має бути, у свою чергу, принаймні одна технічна характеристика (специфікація). Менеджер проєкту може використовувати матрицю простежування під час кваліфікації проєкту (DQ) та чітко засвідчити, що всі вимоги користувачів були враховані. Крім того, він може використовувати матрицю для перевірки, чи всі технічні характеристики специфікації є повними, а їхня технічна реалізація відповідає вимогам. Як останній крок матрицею простежування можна послуговуватись під час складання плану тестування (у разі приймання та кваліфікації) для доказу, що всі вимоги користувачів були протестовані (табл. 3).
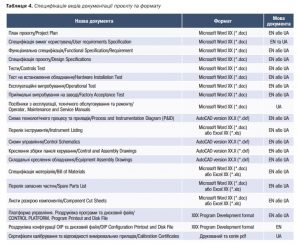
Якісно підготовлена документація з боку постачальника дозволить прискорити проведення кваліфікації системи. Необхідно вимагати, щоб усі необхідні для кваліфікації документи були надані зрозумілою мовою та представлені у потрібному форматі. Приклад таблиці вимог замовника щодо документації проєкту наведено в табл. 4.
Першочерговим завданням підприємства є визначення технологічних показників і нормативних вимог у вигляді URS. У процесі створення URS важливо врахувати вимоги всіх зацікавлених сторін, але з регуляторної точки зору система має бути валідована на відповідність вимогам користувача та GMP. Кваліфікація проєкту системи для водопідготовки починається з документованої оцінки FDS і DDS. Після виготовлення системи, на етапі приймання на заводі-виробнику (FAT), по-тім на підприємстві (SAT) та підчас подальшої валідації в рамках IQ, OQ, PQ не менш важливо протестувати, що постачальник виконав усі вимоги, зазначені в URS. Позитивні результати вищевказаних перевірок будуть передумовою надійної роботи системи та відповідної якості води, що відтворюється, для фармацевтичних цілей у майбутньому.
Враховуючи географію потенційних постачальників, бажано використовувати, за їхньої наявності, міжнародні стандарти(наприклад, ISO) та інші, визнані на міжнародному рівні підходи до побудови системи для водопідготовки. Нижче наведено приблизний перелік таких документів.
- ISPE Baseline —Pharmaceutical EngineeringGuide, Vol. 5 Commissioningand Qualification.
- ISPE Good Practice Guide —Good Engineering Practice,2008.
- ISPE Guidance GAMP 5 —ARisk-Based ApproachtoCompliant GxPComputerized Systems.
- ISPE Good Practice Guide,"Commissioning andQualification ofPharmaceutical Water andsteam systems", 2-ге видан-ня, 2014.
- WHO Good ManufacturingPractices, Annex 3: WaterforPharmaceutical Use.WHOTechnical ReportSeries, No. 1033, 2021.
- Baseline PharmaceuticalEngineering Guide, Volume 4,"Water and steam systems",ISPE, 2019.

Про автора
Петро Шотурма—інженер-технолог фармацевтичного виробництва, випускник Національного фармацевтичного університету(м. Харків, Україна).Загальний досвід роботи у фармацевтичній галузі — 23роки. Провів понад 50 експертиз проєктів фармацевтичних підприємств, брав участь у більш ніж 100 аудитах фармацевтичних підприємств із виробництва як АФІ, так і лікарських засобів.
www.linkedin.com/in/petr-shoturma-20630723



