В предыдущих номерах журнала «Фармацевтическая отрасль» мы обсуждали мировые тенденции и практики внерения механизмов защиты лекарственных средств (ЛС) от фальсификации глобальными фармкомпаниями – теперь пришло время сфокусироваться на украинском фармацевтическом рынке.
В предыдущих номерах журнала «Фармацевтическая отрасль» мы обсуждали мировые тенденции и практики внерения механизмов защиты лекарственных средств (ЛС) от фальсификации глобальными фармкомпаниями – теперь пришло время сфокусироваться на украинском фармацевтическом рынке.
Несмотря на то, что Украина была первой среди стран, которые ратифицировали Конвенцию Совета Европы (Medicrime) о подделке ЛС и аналогичных преступлениях, связанных с угрозой здоровью населения, данное намерение наша страна, к сожалению, так и не реализовала. Первую попытку разработки и внедрения Системы защиты ЛС от фальсификации в Украине осуществляла Гослекслужба Украины в тесном сотрудничестве с Европейским директоратом по качеству лекарственных средств и здравоохранения Совета Европы (European Directorate for the Quality of Medicines & HealthCare – EDQM), которая отвечает за реализацию аналогичного проекта в Европе. В мае 2013 г. между Гослекслужбой Украины и EDQM был подписан Меморандум о сотрудничестве в сфере разработки и внедрения системы отслеживания ЛС во избежание ошибок, допущенных в процессе апробации Системы на территории стран ЕС, а также с целью сэкономить время и бюджетные средства, выделяемые на реализацию проекта. В Меморандуме 2013 г., так же как и в Концепции 2019 г., было предусмотрено три последовательных этапа внедрения данной Системы. Пилотный проект должен был завершиться в 2017 г., но до финишной прямой дошли не все или, вернее будет сказать, не те, кто участвовал в его запуске.
В 2013 г. в качестве участников проекта были заявлены: ЧАО «Фармацевтическая фирма «Дарница», «Нобель Фарма» в Украине, компания «Альба Украина» и столичное КП «Фармация». На закупку программного обеспечения, а также увеличение возможностей серверов Гослекслужбы Украины правительство выделило UAH 15 млн (USD 1,875 млн по курсу Межбанка). Глеб Загорий, ЧАО «ФФ «Дарница», тогда заявил, что для фармпроизводителя средняя стоимость стандартного технического решения по внедрению Системы составляет USD 50 – 60 тыс. К концу 2017 г. Гослекслужба Украины сообщила, что в рамках пилотного проекта по отслеживанию оборота ЛС от производителя до конечного потребителя ОДО «ИнтерХим» передало ООО «БаДМ» 1000 упаковок препарата Амиксин ИС (таблетки, покрытые оболочкой, по 0,125 г, № 3 производства ОДО «ИнтерХим») с
соответствующей маркировкой GS1 Datamatrix. Указанный препарат был принят, информация об индивидуальном коде каждой упаковки (GS1 Datamatrix) отсканирована и загружена в базу данных ООО «БаДМ».
Следующим этапом должно было стать поступление указанного препарата в розничные аптечные учреждения с передачей информации о маркировке упаковки ЛС и внесением их в автоматизированную систему Гослекслужбы. Но на этом этапе пилотный проект завершился. Отметим, что все ЛС производства ОДО «ИнтерХим» независимо от их категории имеют защитную маркировку, что обошлось предприятию в EUR 250 тыс. Компания разработала собственную программу, и сегодня покупатель с помощью гаджета может считать код с упаковки препарата, ознакомиться со всей информацией о нем и проверить его подлинность в аптеке (рисунок).
С ноября 2017 г. открытым остается вопрос о том, кто будет аккумулировать и сохранять всю информацию о ЛС, а также обеспечивать доступ к ней. Ответов на этот вопрос от регулятора представители и участники фармбизнеса Украины пока не получили.
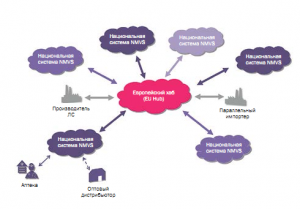
Механизм обмена информацией в ЕС между участниками рынка прозрачен и известен. Производители загружают информацию, содержащуюся в уникальном идентификаторе каждого препарата, в центральный репозиторий ЕС. Хранилище является частью сквозной системы проверки ЛС, введенной в соответствии с Регламентом. В зависимости от источника ЛС оптовикам также нужно его сканировать в разных точках цепочки поставок, чтобы проверить их подлинность. Аптеки и больницы затем просканируют каждый препарат в конце цепочки поставок, чтобы проверить их подлинность и выписать из хранилища, прежде чем выдавать пациентам. В Украине пока отсутствует схема передачи информации регулятору, но в Концепции 2019 г. оговорены сроки и ответственные по всем направлениям реализации данного проекта в нашей стране (более подробно читайте в № 3 (74), 2019 журнала «Фармацевтическая отрасль»). Постановление Кабинета Министров (ПОСТАНОВА від 24 липня 2019 р. № 653 «Про запровадження пілотного проекту щодо маркування контрольними (ідентифікаційними) знаками та проведення моніторингу обігу лікарських засобів», далее – Постановление) внесло определенную ясность в отношении требований и методов защиты ЛС. Описаны обязательства только производителя передавать данные в Министерство здравоохранения (МЗ). Фармацевт должен считать / проверить ЛС перед его продажей конечному потребителю. Таким образом, нет сформированного механизма отслеживания движения ЛС в цепочке поставок – от производителя до конечного покупателя. Этот пробел в Концепции и законодательстве регулятору обязательно следует устранить, поскольку существует риск проникновения контрафактной продукции в легальную цепочку оборота ЛС.