 Мария Думанчук, независимый эксперт по вопросам Track & Trace
Мария Думанчук, независимый эксперт по вопросам Track & Trace
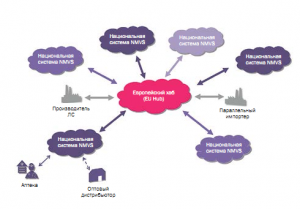
В ответ на активную защиту лекарственных средств (ЛC) от фальсификации в мире законодательство Украины пополнилось новыми нормативно-правовыми актами, которые все четче формируют правила и направление движения, однако большое количество вопросов все-таки остаются открытыми. Первый документ – Концепция реализации государственной политики по предотвращению фальсификации лекарственных средств (далее – Концепция) – был принят 3 апреля 2019 г. В нем изложены видение и этапы внедрения в Украине системы защиты ЛС от фальсификации. Затем было принято Постановление № 653, в котором определены сроки проведения пилотного проекта, разработки системы сбора и хранения серийных номеров (прототип европейского репозитория, так называемого EU Hub), а также изложены требования, предъявляемые к 2D-кодированию.
Видны активная работа профильного министерства и их диалог с участниками рынка. Уже 3 сентября 2019 г. появился проект внесения изменений к Постановлению, который предусматривает увеличение сроков проведения пилотного проекта и введение защиты контроля первого вскрытия. 24 сентября этого года состоялась Международная конференция «Индустрия 4.0: Передовые решения для фармацевтического производства, технологий и упаковки». На одной из секций «Track & Trace, сериализация, агрегация, маркировка, этикетирование» компании-провайдеры презентовали решения для защиты ЛС от фальсификации. В обсуждении Концепции, Положения и пилотного проекта участвовали Марина Слободниченко, эксперт Министерства здравоохранения Украины (МЗ) по внедрению 2D-кодирования, Управляющий партнер Юридической компании «Кайрос груп», глава комитета по медицинскому праву АЮУ, и Николай Свердел, заведующий сектором администрирования баз данных Гослекслужбы Украины.
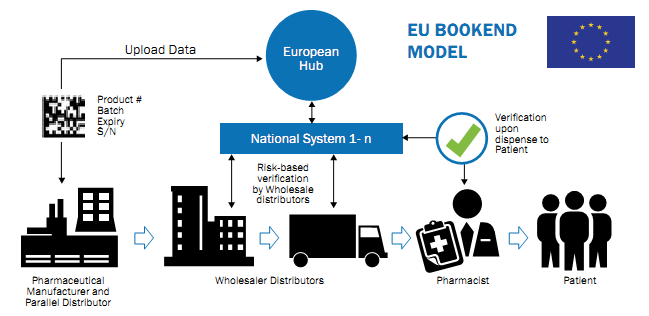
Марина Слободниченко в своей презентации «Правові аспекти впровадження маркування упаковок ліків контрольними знаками» отметила, что согласно Делегированному Регламенту ЕС 2016/161 уникальный идентификатор наносится на рецептурные и безрецептурные ЛС, которые подлежат реимбурсации (рис. 1). Представленная формулировка может ввести в заблуждение, поскольку в ЕС критерием сериализации является не принадлежность ЛС к реимбурсации, а другие параметры. Существует множество разных классификаций ЛС: по терапевтическому применению; фармакологическому действию; химическому строению; нозологическому принципу и т.д. Но все ЛС делятся на две большие категории: рецептурные и безрецептурные. В ЕС именно данный критерий принадлежности препарата является определяющим для нанесения 2D-кода, за исключением некоторых ЛС согласно утвержденному списку.
Хотелось бы уточнить: все ли ЛС в Украине подлежат нанесению уникального идентификатора или только те, которые входят в перечень реимбурсации? Какой из критериев является основополагающим в определении принадлежности ЛС для сериализации?
Открытым остался вопрос о необходимости наличия контроля первого вскрытия и каких именно ЛС он касается. Предполагает ли регулятор предъявить свои требования к данному виду защиты или производитель волен самостоятельно выбирать способ обеспечения контроля первого вскрытия?