Міріам Фонтанільо, Борис Керс і Алекс Моннар, автори цієї статті, що вийшла у серпні 2022 р., розкажуть, як компанії можуть прискорити час виходу біосимілярів на ринок, зменшити витрати на проведення досліджень і розробку та підвищити їхню продуктивність.
Попит на біологічні препарати, які діють на певні шляхи та клітини при таких складних для лікування патологіях, як рак і рідкісні захворювання, зростає. Завдяки впровадженню нових модальностей, зокрема мРНК, застосування біопрепаратів розширює для пацієнтів і медичних працівників спектр можливостей щодо лікування. Однак великі витрати на розробку цих препаратів часто ускладнюють їхню доступність. Біосиміляри відкривають доступ до широкого спектра методів лікування за нижчою ціною, допомагаючи як пацієнтам, так і системі охорони здоров’я в цілому заощадити гроші та звільнити ресурси, які можна пере розподілити на інші сфери догляду за пацієнтами.
Окрім того, у найближчі 10 років понад 55 найвідоміших препаратів із максимальним обсягом продажів на більш як USD 1 млрд втратять ексклюзивність. Тому існує ймовірність, що конкуренція між біосимілярами зростатиме. У цьому контексті передумовою успіху біосимілярів буде ранній запуск за максимально низьких витрат на їхню розробку. Але оскільки біосиміляри націлені на дедалі складніші молекули та технологічні платформи, витрати на дослідження і розробки, ймовірно, будуть збільшуватися, що, своєю чергою, потребуватиме ще більшого контролю витрат, аби зробити бізнес стійкішим.
Нижче ми розкажемо про можливості та визначимо три кроки, спрямовані на прискорення R&D і зменшення витрат для успішного позиціонування своєї компанії протягом наступних 10 років.
Входячи у наступну хвилю зростання
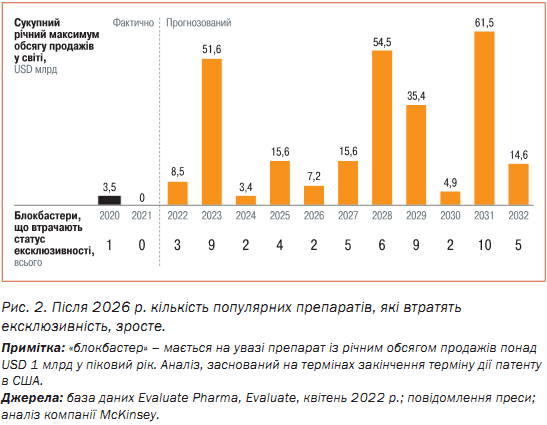 До 2030 р. світовий ринок біосимілярів може становити USD 74 млрд, що втричі перевищить його сьогоднішню ринкову вартість (рис. 1).
До 2030 р. світовий ринок біосимілярів може становити USD 74 млрд, що втричі перевищить його сьогоднішню ринкову вартість (рис. 1).
На ринку США впродовж 2015 – 2021 рр. спостерігалося найшвидше збільшення обсягу біосимілярів із CAGR-97% порівняно із 48% в Європі та 39% в решті країн світу. Незважаючи на те, що прогнози до 2025 р. засвідчують нижчі темпи зростання, США, як очікується, залишаться на першому місці з CAGR 26%. Далі йдуть Європа та решта країн світу з 8 і 16% відповідно.
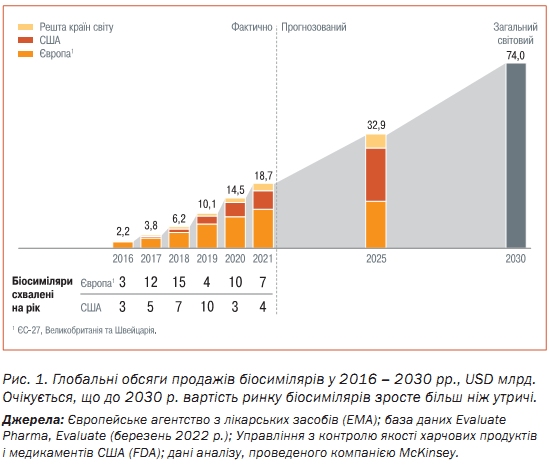
Наш аналіз показує, що до 2032 р. понад 55 популярних препаратів, які втратять ексклюзивність у США і Європі, матимуть сумарний максимум обсягу продажів понад USD 270 млрд. До 2025 р. 19 глобальних брендів-хітів втратять ексклюзивність. З 2026 по 2032 рр. цей темп прискориться, і вже 39 блокбастерів ризикують «програти». Ця група включає щонайменше п’ять мегабрендів із річним обсягом продажів понад USD 10 млрд (рис. 2).
Оскільки все більше компаній виходить на цей привабливий ринок, швидкість запуску біосимілярів стає важливішою. Аналіз компанії McKinsey щодо трьох найбільш продаваних біосимілярів для деяких молекул на кількох ринках підтвердив, що перші учасники отримують його велику частку.
Попри перспективи розвитку й динаміку галузі, гостра конкуренція та потенційно низькі прибутки збентежили деякі компанії, які знизили рівень своєї діяльності. У 2018 р., наприклад, Boehringer Ingelheim оголосила, що піде з європейських ринків та зосередиться на запуску своїх біосимілярів у США. Компанія Pfizer попередила, що наступного року відмовиться від п’яти доклінічних проєктів біосимілярів і перерозподілить фінансування на програми, що перебувають наразі на пізній стадії.
Успіх виробництва біосимілярів залежить від управління витрата-ми, а також від прискорення їхнього випуску. Аналіз, проведений компанією McKinsey, показує, що розробка типового біосиміляра коштує від USD 100 до 300 млн, а від аналітичної характеристики до схвалення проходить від 6 до 9 років. На проведення клінічних випробувань припадає більше половини як бюджетів, так і часових витрат. Науково-дослідні відділи компаній повинні докласти більших зусиль, щоб запобігти подальшому подовженню термінів і збільшенню витрат. Галузь рухається від виробництва відносно простих молекул у мікроорганізмах до отримання рекомбінантних білків із клітин ссавців і розробки моноклональних антитіл.
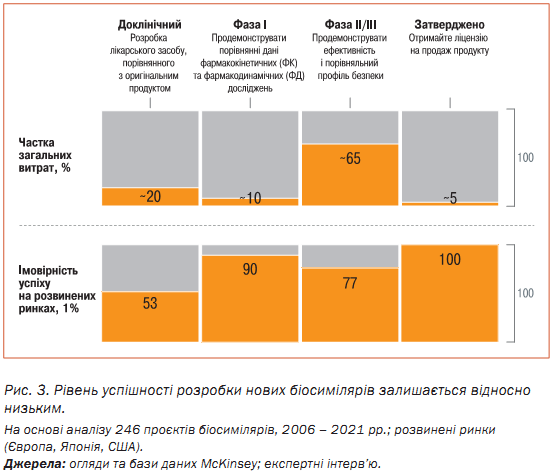
У той же час ймовірність успіху залишається низькою, особливо на доклінічних етапах: на ринках США, Європи та Японії здобуто в середньому 53% успішних результатів. Ці показники значно різняться залежно від терапевтичної галузі: наприклад, 43% в онкології, але лише 8% – в імунології. Тим не менш важливо зазначити, що більшість невдач є результатом рішень зупинити проєкти зі стратегічних причин, таких як зміна напрямку діяльності компанії або зростання конкуренції, а не через клінічні чинники. Рівень успішних результатів також не враховує необхідність повторювати проєкти (наприклад, повторне проведення клінічних випробувань) після початкових невдач. Це, вочевидь, впливає як на загальні витрати, так і на терміни (рис. 3).
Наші дослідження та бесіди з експертами галузі допомогли визначити три сфери, в яких провідні компанії, що спеціалізуються на біосимілярах, повинні діяти, аби прискорити терміни розробки, зменшити витрати та забезпечити адекватну віддачу від інвестицій.
- Трансформуйте процеси досліджень і розробок за допомогою цифрових технологій
Компанії мають можливість упроваджувати цифрові інновації в кількох точках розробки ліків. Диджиталізація все ще перебуває на початковій стадії впровадження в сфері виробництва біосимілярів. Але деякі компанії вже ввели, наприклад, автоматизацію процесів або робототехніку, що дозволяє їм проводити кілька експериментів паралельно та стандартизувати процеси, щоб запобігти відхиленням і зменшити загальні витрати.
Менше досвіду набуто в сфері моделювання та прогнозування in silico. Деякі компанії використовують, зокрема, цифрові двійники для моделювання вологих експериментів для оптимізації (наприклад, вибору середовища, параметрів процесу бродіння, стабільності і аналітичних методів). Новими сферами впровадження є комплексний моніторинг у режимі реального часу, інтеграція та автоматизований збір даних і подача їх до центральної системи, а також генерування та управління знаннями.
Компанії, що спеціалізуються на розробці біосимілярів і впроваджують диджиталізацію, досягли перших успіхів, які в подальшому матимуть довгостроковий вплив.
- Стежте за ситуацією в галузі та готуйтеся до змін
Оскільки протягом останнього десятиліття було розроблено більше біосимілярів, нормативні регламенти також розвивалися. Різні регуляторні органи використовують дещо різні підходи. У майбутньому ми очікуємо змін у двох основних сферах – випробування фази III і дослідження взаємозамінності, які можуть справляти глибокий вплив на динаміку галузі.
Випробування фази III
FDA або EMA не вимагає проведення випробувань фази III як умову для схвалення біосимілярів. Проте такі дослідження все ще широко проводять, і вони потрібні, якщо існує залишкова невизначеність щодо ефективності та безпеки біосиміляра порівняно з його референтним продуктом. Однак, якщо надійні дані ФК і ФД досліджень підтверджують, що біоаналог і референтний препарат клінічно подібні, компанії можуть вимагати відмови від досліджень фази III. Кожен випадок слід оцінювати окремо.
Наприклад, у випадку з біоаналогом пегфілграстиму компанії Coherus FDA відмовилося від випробувань фази III для подання та визнало дані фази I як достатні. FDA також скасувало випробування фази ІІІ біоаналогів інсуліну, якщо були доступні достовірні дані ФК і ФД досліджень. У Сполученому Королівстві Агентство з регулювання лікарських засобів і медичної продукції (MHRA) нещодавно скасувало вимоги фази III випробувань для всіх біосимілярів. Лідери галузі та експерти вважають, що FDA й EMA можуть наслідувати цей приклад у середньо- чи довгостроковій перспективі. Поступові зміни також можуть вплинути на певні типи продуктів або терапевтичні сфери. У будь-якому випадку скасування вимог щодо фази III випробувань біосимілярів, якщо воно відбудеться, може удвічі скоротити витрати на дослідження та розробки і значно прискорити терміни їхнього проведення.
Дослідження взаємозамінності
Розвиток аналітичних наук дозволив використовувати більш передові підходи для оцінки біоподібності. Вимоги до взаємозамінності, ймовірно, будуть переглянуті, і необхідності в проведенні клінічних випробувань для запропонованого біоподібного препарату не буде, якщо порівняльна аналітична оцінка підтвердить його «високу схожість». Це може мати значний вплив на динаміку галузі. Менші витрати на розробку та коротші терміни можуть зробити ринок більш привабливим для нових учасників, таких як компанії, що випускають генерики, а поєднання менших витрат на розробку й посилення конкуренції, ймовірно, сприятимуть зниженню цін.
Компанії, що спеціалізуються на виробництві біосимілярів, повинні помічати перші ознаки змін у галузевому ландшафті, розробляти низку планів на випадок виникнення непередбачених ситуацій і розвивати гнучкість, щоб швидко пристосовуватися та перерозподіляти ресурси на різні потреби.
- Зміцнення основ шляхом удосконалення операційної моделі R&D
Компанії, що спеціалізуються на випуску біосимілярів, можуть поліпшити операційну модель досліджень і розробок у трьох основних сферах: процеси, аутсорсинг і розподіл спеціалістів.
Оптимізація процесів може допомогти компаніям не тільки прискорити терміни та скоротити витрати, але й сприяти співпраці, зосередити увагу на ключових процесах і «вузьких місцях», а також поліпшити способи роботи в цілому. Оптимізація процесу починається з окреслення критичного шляху – послідовності кроків, необхідних для розробки продукту. Прискорення або затримка будь-якого кроку на критичному шляху негайно вплине на часові лінії розвитку для всього процесу. Далі компанії повинні визначити взаємозалежності між процесами. Нарешті, кожен процес слід детально оцінити, щоб зрозуміти, чи можна прискорити критичний шлях і, якщо так, то яким саме чином.
Цей підхід може передбачати більш раннє здійснення деяких кроків. Наприклад, виконувати роботи з оптимізації початкових процесів до завершення попереднього еквівалента або виключати вибрані процеси, такі як проміжні етапи масштабування. Інші можливості включають паралельне, а не послідовне виконання процесів (скажімо, пілотні експерименти для одночасного тестування різних умов) або стандартизацію процесів – наприклад, дотримуючись підходу до формулювання платформи, щоб уникнути створення нових процесів з «нуля» для кожного продукту.
Аутсорсинг є дійсно ефективним, оскільки він дозволяє компанії зосередитися на своїх відмінних можливостях, передавши більш стандартну роботу кваліфікованим третім особам. Завдяки цьому компанія зможе скоротити часові рамки, розподілити витрати та максимізувати свою реакцію на зміни попиту чи обмеження потужностей. Такі партнерства можуть обмежуватися певною діяльністю, наприклад, передаванням прав на проведення клінічних випробувань контрактним дослідницьким організаціям (CRO) або охоплювати весь процес розробки активу.
Оскільки протягом наступних кількох років складніші молекули втратять свою ексклюзивність, компанії, що спеціалізуються на виробництві біосимілярів, можуть стикнутися з проблемою пошуку нових моделей аутсорсингу з метою отримання доступу до розширених можливостей, наприклад, до складних методів аналітичного моделювання. Це можуть передбачити потенційні результати експериментів або процедур та зменшити кількість і вартість імовірних збоїв. Гнучкі партнерські відносини також допомагають компаніям отримати доступ до додаткових можливостей у години пік, щоб швидкість не стала загрозою. Зважаючи на такі потреби, деякі компанії інтегруються вперед чи назад уздовж ланцюжка створення вартості або використовують гібридні моделі, поєднуючи інсорсинг із партнерством. Компанія Teva, наприклад, розробила деносумаб, філграстим та епоетин власними силами, але співпрацювала з Celltrion для виробництва трастузумабу і ритуксимабу, з Alvotech – для розробки адалімумабу та устекінумабу, а з Bioeq – ранібізумабу.
Розподіл спеціалістів має вирішальне значення для такої сфери, як біосиміляри, в якій ще недостатньо знань і досвіду. Результати дослідження, проведеного McKinsey, показують, що динамічні моделі розподілу спеціалістів можуть допомогти компаніям поєднати дефіцитні навички з вирішенням високопріоритетних завдань, поліпшити розвиток персоналу і зробити бізнес більш сприйнятливим до змін. Наприклад, у рамках моделі flow to work деяких працівників залучають до гнучкості, заснованого на навичках пулу роботи, а не до виконання конкретної функції. Потім ці співробітники протягом повного або неповного робочого дня вдосконалюють свої знання для виконання завдань або проєктів, які найбільше потребують їхніх навичок. Такий підхід дає змогу окремим спеціалістам розширювати свій досвід, а організаціям – швидко ділитися інформацією та діяти на її основі в середовищі, що стрімко змінюється.
Оскільки виникають нові можливості трансформації, компаніям, які займаються виробництвом біосимілярів, слід розглянути їхні стратегічні наслідки. Для одних це може означати створення можливостей для розробки біосимілярів для більш складних продуктів, патент на які буде припинено найближчим часом, для інших – прискорення темпів запуску. Для багатьох це передбачатиме уважне спостерігання за розвитком подій і планування відповідей на низку сценаріїв – нормативних змін до зниження цін. Хоча пріоритети залежать від компанії, прискорення проведення досліджень і розробок, зниження витрат і підвищення продуктивності, ймовірно, будуть пріоритетними для будь-якої ефективної стратегії розробки біосимілярів.


